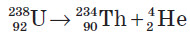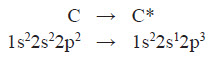Дистанційний центр хімічної освіти
|
Меню сайту
Наше опитування
Статистика
Онлайн всього: 1 Гостей: 1 Користувачів: 0 ...

Зворотній зв'язок
|
Будова атомаАтом складається з позитивно зарядженого ядра і негативно заряджених електронів. Ядро атома складається із частинок двох видів — протонів і нейтронів. Протони — це позитивно заряджені частинки із зарядом +1, а нейтрони не мають заряду. Виходить, що весь позитивний заряд ядра створюється протонами. Їхнє загальне число дорівнює заряду ядра. Маси протона й нейтрона приблизно дорівнюють 1 а. о. м. Будь-який атом електронейтральний, тобто число протонів із зарядом +1 завжди дорівнює числу електронів із зарядом -1 . У всіх атомів одного й того самого хімічного елемента число протонів Z завжди однакове (і дорівнює заряду ядра), а число нейтронів N буває різним, тому маса атомів одного й того самого елемента може бути різною. Це означає, що не маса, а саме заряд ядра є основною характеристикою, за якою атоми одного виду відрізняються від атомів іншого виду. У ході докладнішого вивчення атомів було з’ясовано, що число протонів в атомах не є довільним, а дорівнює порядковому номеру хімічного елемента в Періодичній системі хімічних елементів Д. І. Менделєєва, адже й заряд ядра також дорівнює порядковому номеру. Атомні ядра одного й того самого хімічного елемента містять однакове число протонів, що дорівнює порядковому номеру цього елемента в Періодичній системі. Але якщо протонів в атомних ядрах певного хімічного елемента має бути строго визначене число, то число нейтронів у ядрі таких атомів може бути різним. Наприклад, у ядрі атомів Оксигену міститься 8 протонів (порядковий номер Оксигену в Періодичній системі — 8). А число нейтронів може бути 7, 8, 9 і навіть 10, адже серед атомів Оксигену можна виділити чотири різні набори протонів і нейтронів. Кожний такий набір (різновид атомних ядер) називають нуклідом. Нуклід — це різновид атомів з певним числом протонів і нейтронів у ядрі. Кожний нуклід характеризують певними числами. Протонне число (або зарядове число, або атомне число) — Z — позначає число протонів у ядрі атома певного нукліда. Нейтронне число — N — указує число нейтронів у ядрі певного нукліда. Масове число — А — це сума протонного та нейтронного чисел: Масове число = Протонне число + Нейтронне число; A = Z + N . Масове число = протонне, число + нейтронне число = нуклонне число. Оскільки маса кожного протона й нейтрона дорівнює приблизно 1 а. о. м., а електрона — дуже мала, то масове число кожного атома приблизно дорівнює його відносній атомній масі, округленій до цілих чисел. Знаючи порядковий номер елемента та масове число нукліда, неважко обчислити, скільки електронів, протонів та нейтронів містить певний атом. Число електронів дорівнює числу протонів Z, що збігається з порядковим номером (зарядом ядра), а число нейтронів N дорівнює різниці між масовим числом А та зарядом ядра: N = A − Z . Усі нукліди, які мають однаковий заряд (протонне число) і різне нейтронне число, називають ізотопами. Оскільки нукліди з однаковим протонним числом належать до одного хімічного елемента, то: різні нукліди одного хімічного елемента є ізотопами. Зазвичай нукліди хімічних елементів не мають власних назв, єдиним винятком серед них є Гідроген. Його нукліди позначаються спеціальними символами й мають різну назву. Звичайний Гідроген Н ( 1H) — Протій, ядра його атомів складаються тільки з одного протона. Важкий Гідроген D ( 2H) — Дейтерій, у ядрах його атомів, окрім одного протона, міститься ще один нейтрон. І надважкий Гідроген Т (3H) — Тритій, у ядрах його атомів, окрім одного протона, міститься два нейтрони. Ядерні перетворення Усі нукліди поділяють на стабільні та нестабільні. Стабільні нукліди існують нескінченно довгий час. Переважне число атомів, які нас оточують, відносяться до стабільних нуклідів. Нестабільні нукліди піддаються радіоактивному розпаду й утворюють атоми інших елементів.
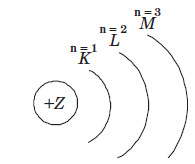
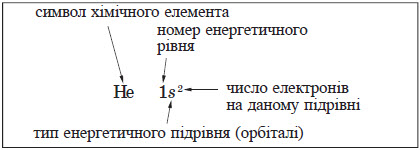
Процеси перетворення ядер атомів (ядерні реакції) супроводжуються випромінюванням. Розрізняють три види радіоактивного випромінювання: а-, b і y-випромінювання. Рух електронів в атомі. Орбіталі В атомі електрон перебуває не в одній конкретній точці, а рухаючись, утворює електронну хмару, густина якої (електронна густина) показує, в яких місцях електрон буває частіше, а в яких — рідше. Ту частину електронної хмари, в якій електрон проводить найбільший час й у якій електронна щільність досить велика, називають атомною орбіталлю. Орбіталь — це область простору, в якій ймо вірність перебування електрона становить понад 90 %. Електронні хмари, утворені окремими електронами в атомі, у сумі утворюють спільну електронну хмару атома — електронну оболонку. Типи орбіталей Кожна орбіталь має певну форму. Орбіталі різної форми позначають різними літерами: s, р, d та f. s-Орбіталі мають форму кулі, інакше кажучи, електрон, що перебуває на такій орбіталі (його називають s-електроном), більшу частину часу проводить усередині сфери. р-Орбіталі мають форму об’ємної вісімки. Форми d- і f-орбіталей більш складні. Структура орбіталей в атомі Орбіталі характеризуються не тільки формою, але й енергією. Кілька орбіталей, що мають однакову або приблизно однакову енергію, утворюють енергетичний рівень, або енергетичний шар. Кожний енергетичний рівень позначають числом n (n = 1, 2, 3,…) або великою латинською літерою (К, L, М і далі за абеткою). Для першого (найближчого до ядра) рівня n = 1, його по значають літерою К, для другого n = 2 (рівень L), для третього n = 3 (рівень М) тощо. Шарувату будову електронної оболонки атомів можна показати так: окружністю позначене ядро, що має певний заряд, а дугами — енергетичні рівні:
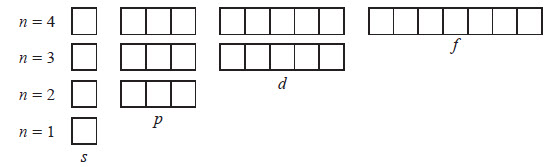
Рівень із номером n включає n2 орбіталей. Таким чином, перший енергетичний рівень включає одну орбіталь, другий — чотири, третій — дев’ять тощо. Енергетичний підрівень може містити тільки певне число орбіталей. Кожен s-підрівень представлений однією s-орбіталлю, р-підрівень — трьома р-орбіталями, d-підрівень — п’ятьма d-орбіталями, f-підрівень — сімома f-орбіталями. В атомі ці орбіталі розташовуються таким чином, що ядро атома збігається із центром орбіталі. Графічно орбіталь заведено позначати квадратом. Отже, орбіталі перших чотирьох енергетичних рівнів будуть мати такий вигляд:
На кожній орбіталі максимально можуть розміститися два електрони, які мають однакову енергію, але відрізняються особливою властивістю — спіном. Спін електрона — це його внутрішня властивість, що характеризує відношення електрона до магнітного поля. Одна орбіталь може містити такі два електрони, в яких спіни антипаралельні. Це правило називають принципом заборони Паулі: на одній орбіталі можуть перебувати не більше двох електронів, причому їхні спіни мають бути антипаралельними. Графічно електрони зображають у вигляді стрілок, спрямованих угору або вниз, що наочно позначають напрямок спіну електрона. Стрілки, спрямовані в протилежні боки, позначають електрони з протилежними спінами:
Усі хімічні властивості речовин визначаються будовою електронних оболонок атомів. Для того щоб описати електронну будову атомів, необхідно знати, як саме розподілені електрони по орбіталях. Число енергетичних рівнів, які заповнюються в певному атомі, визначають за номером періоду Періодичної системи, в якому розташований певний хімічний елемент. Так, в атомах хімічних елементів першого періоду заповнюється тільки перший енергетичний рівень, в атомах другого періоду — перші два енергетичні рівні, третього — три тощо. Гідроген розташований у першому періоді під номером 1. Із цього випливає, що в електронній оболонці атомів Гідрогену є тільки один електрон, який розташований на першому енергетичному рівні на єдиній s-орбіталі:
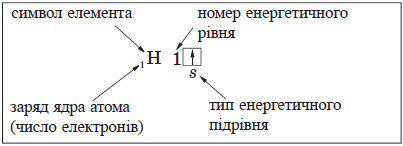
Окрім графічного зображення будови електронної оболонки, використовують також її запис у вигляді формули — електронної конфігурації, в якій наводять усі зайняті енергетичні підрівні із зазначенням числа електронів на кожному з них. Електронна конфігурація Гідрогену 1s 1 .
Розподіл електронів по орбіталях відбувається за правилом Хунда: У межах одного енергетичного підрівня електрони розташовуються таким чином, щоб число неспарених електронів було максимальне. Атом Карбону чотиривалентний. Для того щоб виявляти таку валентність, він повинен мати чотири неспарених електрони. Це досягається в результаті збудження атома і переходу одного електрона із 2s-орбіталі у вакантну 2р-орбіталь:
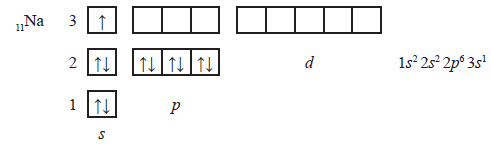
Електронні оболонки атомів інших періодів заповнюються за такими самими правилами. Так, в атомів першого елемента третього періоду — Натрію — починає заповнюватися третій енергетичний рівень:
Структура Періодичної системи повністю обумовлюється принципами будови електронної оболонки атомів. Число хімічних елементів, що містяться в кожному періоді, визначається місткістю відповідних енергетичних шарів. Число орбіталей на кожному енергетичному рівні визначається за формулою n 2 , де n — номер енергетичного рівня. Оскільки кожна орбіталь містить щонайбільше два електрони, то максимальне число електронів на кожному енергетичному рівні буде 2n 2 . Атомні орбіталі поділяють за типами на s, p, d та f. За цим же принципом можна класифікувати й хімічні елементи. Якщо в атомах хімічного елемента останнім заповнюється s-підрівень, то такі елементи відносять до s-елементів. У Періодичній системі клітинки з такими елементами зазвичай зафарбовують у червоний колір. Якщо останнім заповнюється p-підрівень, то такий елемент називають р-елементом, і його клітинку в Періодичній системі зафарбовують, як правило, у жовтий колір. d-Підрівень заповнюється в d-елементів (синій колір у Періодичній системі) і f-підрівень у f-елементів (зелений колір). Хімічні елементи, в атомах яких відбувається заповнення електронами передзовнішнього енергетичного рівня, називають перехідними. Розподіл елементів по головних та побічних підгрупах також обумовлюється будовою електронних оболонок. До головних підгруп входять тільки s- та р-елементи, в яких заповнюється зовнішній енергетичний рівень, а до побічних груп входять d-елементи, в яких заповнюється передзовнішній електронний шар. Хімічні властивості елементів обумовлюються не всіма електронами, а тільки тими, які мають найбільшу енергію. Ці електрони називають валентними. Саме від числа валентних електронів залежить те, є елемент металом чи неметалом, властивості його сполук та значення валентності в цих сполуках. Якщо в атомах елементів на зовнішньому рівні є невелике число електронів (переважно від одного до чотирьох), то елемент проявляє металічні властивості, а якщо на зовнішньому рівні є більше чотирьох електронів, то елемент проявляє переважно неметалічні властивості. Чим більшим є число електронів на зовнішньому рівні, тим більше виражені неметалічні властивості й менше — металічні. Атоми, які містять на зовнішньому рівні число електронів, проміжне між металічними й неметалічними (зазвичай це три-чотири), утворюють амфотерні сполуки. Залежність металічних і неметалічних властивостей від будови зовнішнього електронного шару Заряджений атом або групу атомів називають йоном. Розрізняють катіони — йони з позитивним зарядом, та аніони — негативно заряджені йони. Металічні властивості обумовлюються здатністю віддавати електрони, а неметалічні — здатністю їх приєднувати. У періоді зі збільшенням порядкового номера металічні властивості зменшуються, а неметалічні — зростають. Кожний період починається найбільш активним (серед елементів певного періоду) металічним елементом, а наприкінці періоду розташований найбільш активний неметалічний елемент (у групі VII) та інертний газ (у групі VIII). Електронні конфігурації йонів можна вивести з електронних конфігурацій атомів, додавши до них або віднявши від них потрібне число електронів. Наприклад, електронна конфігурація атома Літію — 1s2 2s1, а йона Літію Li + — 1s2, що збігається з конфігурацією атома інертного газу гелію. При утворенні аніонів додаткові електрони займають вільні орбіталі. Наприклад, конфігурація атома Хлору 1s22s22p63s23p5, а йона Cl - — 1s22s22p63s23p6, що збігається з електронною конфігурацією атома інертного газу аргону. Радіус атома – відстань від центра ядра до сферичної поверхні, якої торкаються орбіта лі з електронами останнього енергетичного рівня. В атомів хімічних елементів одного періоду число електронних шарів, що заповнюється, однакове, адже й радіус їхніх атомів має бути однаковим. Проте в періоді зі збільшенням порядкового номера хімічного елемента заряд ядра послідовно зростає. Електрони зі збільшенням заряду ядра притягуються до нього сильніше, і тому в періоді радіус атомів поступово зменшується. У головних підгрупах зі збільшенням порядкового номера елемента (згори вниз) зростає число зайнятих енергетичних рівнів. Саме тому радіус атомів хімічних елементів однієї групи збільшується. Зміна радіусів атомів у групах пояснює зміну металічних властивостей елементів однієї групи. Чим далі від ядра розташовані валентні електрони (електрони зовнішнього енергетичного рівня), тим менше вони притягуються до ядра, адже зовнішні електрони зі збільшенням радіуса легше віддавати, і це призводить до того, що металічні властивості, які обумовлені здатністю елементів віддавати електрони, у групах зростають. Водночас неметалічні властивості елементів у групах зі збільшенням радіуса атомів (порядкового номера) зменшуються. Металічні властивості, таким чином, найбільш яскраво виражені в нижнього елемента підгрупи, а неметалічні — у верхнього. З огляду на зміни металічних властивостей у періодах, можна стверджувати, що серед усіх хімічних елементів найбільш активним металічним елементом є Францій (оскільки Францій у природі не виявлений, а добутий штучно ядерним синтезом, то серед існуючих елементів найбільш активний металічний елемент — Цезій). А найбільш активний неметалічний елемент — Флуор. |
Форма входу
Пошук
Календар
Калькулятор
Анкета
|
||||||||||||||||||||||||||||||||||||||||||||