Алюміній перебуває в головній підгрупі III групи, належить до рідкісноземельних металів. На його зовнішньому електронному шарі міститься три електрони, які він здатний віддавати.
Алюміній — сріблясто-білий метал. Він ковкий, легко витягується в дріт, tпл = +660 °С, tкип = +2520 °С. При кімнатній температурі алюміній не змінюється на повітрі, тому що його поверхня покрита тонкою оксидною плівкою, яка характеризується сильною захисною дією.
Хімічні властивості
1) Взаємодія з киснем.
Порошкоподібний алюміній активно взаємодіє з йодом за звичайних умов у присутності каталітичної кількості води:
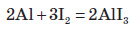
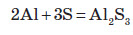
Незважаючи на високу хімічну активність, з водою алюміній не взаємодіє. У першу чергу, завдяки захисній плівці, а також тому, що продукт взаємодії алюмінію з водою — нерозчинна речовина.
Аналогічно до всіх активних металів алюміній витісняє водень із розчинів кислот:
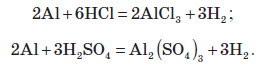
Завдяки тому, що алюміній утворює амфотерні сполуки, він також здатний витісняти водень із розчинів лугів:
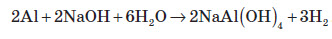
Алюміній є одним із багатотоннажних продуктів металургійної промисловості. Його добувають у величезних кількостях, тому що він є цінним матеріалом і реагентом. У сучасній металургії алюміній добувають електролізом бокситів (алюміній оксиду). Оскільки сам алюміній оксид є дуже тугоплавкою речовиною, для зменшення енерговитрат у боксит додають плавиковий шпат (кальцій фторид), що знижує температуру плавлення руди.
Застосування алюмінію
Алюміній є цінним конструкційним матеріалом. Маючи відносну легкість (густина алюмінію набагато легша, ніж у сталі), він є досить міцним металом. Його використовують для виготовлення легких конструкцій, у сплаві з магнієм для обшивки літаків тощо. З алюмінію виготовляють столові прибори й посуд. У великих кількостях алюміній використовують у металургії для добування металів алюмотермічним способом.
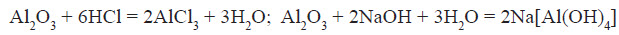
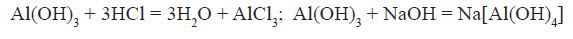
Алюміній-
активний метал, однак із-за оксидної плівки його активність мало помітна.
Алюміній не реагує з водою, тому що на його поверхні утворена оксидна плівка.
Її можна видалити лугом. Коли плівка розчиняється, метал бурно реагує з лугом,
виділяється водень. Перевіримо чи буде взаємодіяти вода з алюмінієм без
оксидної плівки. Видалим луг і промиємо поверхню металу. Алюміній реагує з
водою, виділяється водень і утворюється нерозчинний гідроксид алюмінію.
У пробірку з
бромом поміщаємо шматочок алюмінію. Через деякий час починається бурхлива
реакція. Алюміній запалюється у бромі.


