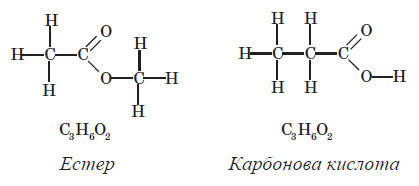
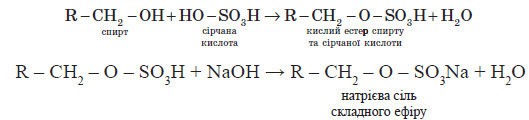Функціональна група естерів подібна до функціональної групи карбонових кислот: функціональна група естерів −COO−, а функціональна група карбонових кислот −COOH. Найпростіший представник естерів:
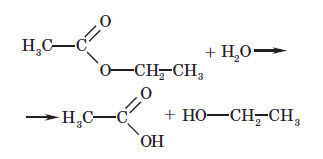
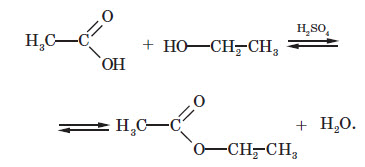
Загальна формула естерів: CnH2nO2, вона збігається із загальною формулою карбонових кислот. Отже, крім усіх типів ізомерії, характерних для карбонових кислот, для естерів характерна також міжгрупова ізомерія з карбоновими кислотами: У лабораторній практиці естери добувають, в основному, кип’ятінням карбонових кислот зі спиртами в присутності сульфатної кислоти. У цьому разі сульфатна кислота відіграє роль каталізатора й водовідіймальної речовини, тобто вона зв’язує утворювану воду й не дозволяє їй вступати у зворотну реакцію гідролізу утворюваного естеру. Реакція естерифікації є оборотною реакцією: поряд з реакцією утворення естеру відбувається зворотна реакція — реакція гідролізу. І рівняння реакції більш правильно записувати так:

Xімічні властивості естерів
З усіх хімічних властивостей естерів найбільш важлива тільки реакція, зворотна реакції естерифікації — гідроліз естерів. Ця реакція відбувається в присутності як кислот, так і лугів, що виступають у ролі каталізаторів:
Естери не розчиняються у воді, добре розчиняються в спирті, етері. Більшість естерів мають приємний запах, унаслідок чого дуже багато естерів застосовують у парфумерії та харчовій промисловості як ароматизатори із фруктовими запахами.
Окрім того, етилформіат використовують для виробництва вітаміну B1; етилацетат і бутилацетат — як розчинники естерів, целюлози, каучуків, вінілових полімерів, жирів і восків, а також як клей для деяких пластмас. Бензилбензоат використовують для боротьби з коростявими кліщами та для лікування корости.
Жири
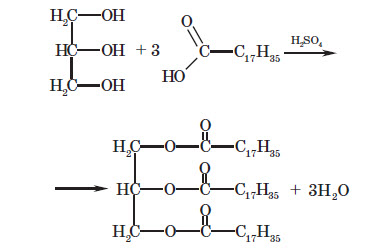
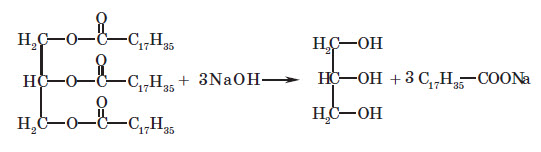
Жири можна охарактеризувати як естери, утво рені трьохатомним спиртом — гліцеролом і трьома молекулами вищих карбонових кислот. З карбонових кислот найчастіше зустрічаються стеаринова кислота C17H35COOH та олеїнова кислота C17H33COOH.
Називають жири, виходячи з їхнього складу: наводячи залишки карбонових кислот, що входять до їхнього складу. Наприклад, тристеариновий жир, або тристеарат (входить три залишки стеаринової кислоти), триолеїновий жир, або триолеат (входить три залишки олеїнової кислоти):
Усі жири поділяють на дві основні групи.
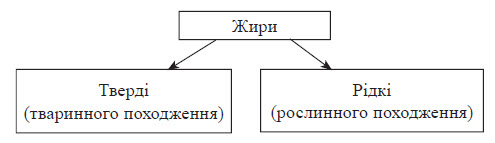
Хоча ця класифікація скоріше біологічна, ніж хімічна, однак можна вивести одну закономірність: тверді жири утворені переважно вищими насиченими карбоновими кислотами, а рідкі — переважно ненасиченими.
Тваринні жири найчастіше тверді (яловичий, баранячий), але зустрічаються й рідкі (риб’ячий жир), тим часом як рослинні жири найчастіше рідкі речовини (льняна, соняшникова олія), але є й тверді (кокосове масло).
Жири дуже широко розповсюджені в природі. Поряд з вуглеводами й білками вони входять до складу всіх рослинних і тваринних організмів і є однією з основних частин нашої їжі.
Усі жири легші, аніж вода. У воді вони нерозчинні, але добре розчиняються в бага тьох органічних розчинниках (дихлоретані, бензині).
Xімічні властивості жирів
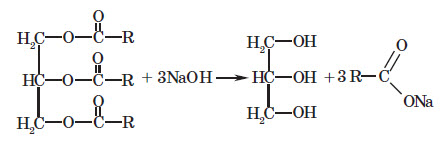
1. Гідроліз жирів. Як і у випадку естерів, гідроліз жирів проводять у присутності лугу (або соди), який перетворює утворені карбонові кислоти на солі. Причому солі вищих карбонових кислот, які при цьому утворюються, є милом, і внаслідок цього реакцію гідролізу (і не тільки жирів, але й естерів) незрідка називають також омиленням:
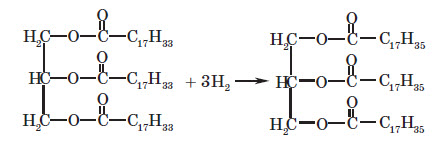
2. Гідрування жирів. Оскільки до складу рідких жирів входять залишки ненасичених карбонових кислот, то вони здатні приєднувати молекули водню. Таким чином рідкі жири перетворюють у тверді. Цей процес дуже часто застосовують для добування комбінованих жирів та маргаринів.
Мило
Милом є солі вищих карбонових кислот. Як і жири, мило можна класифікувати за агрегатним станом у звичайних умовах. Так, розрізняють тверде мило (натрієві солі вищих карбонових кислот) і рідке мило (калієві солі вищих карбонових кислот). Відповідно, формула мила:
C17H35COONa — натрій стеарат та
C17H35COOK — калій стеарат. Основний метод добування мила — гідроліз жирів. Якщо жир нагрівати з розчином соди або лугу, то виходить мило.
Зараз розвивається виробництво мийних засобів іншого типу: це синтетичні мийні засоби
(CMЗ). Один із видів CMЗ являє собою сіль кислих естерів вищих спиртів та сульфатної кислоти.
Схема добування (у загальному вигляді):
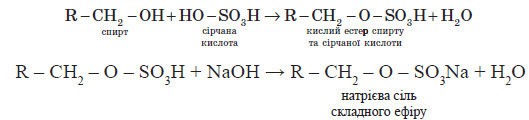
Дуже розповсюдженим видом СМЗ є алкілбензосульфонати:
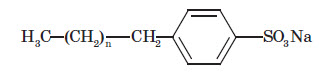
За будовою такі солі подібні до солей, що входять до складу звичайного мила (вони, як і мило, мають поверхневу активність і гарну мийну дію). Але, на відміну від звичайного мила, такі речовини не втрачають мийних властивостей у твердій воді, тому що утворені при цьому кальцієві та магнієві солі виявляються розчинними й, отже, поверхнево-активна речовина залишається у воді, а не випадає в осад.