За рахунок високої стійкості молекули проста речовина поводиться досить пасивно. За звичайних умов азот вступає в реакцію тільки з металічним літієм:
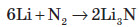
При нагріванні азот взаємодіє з деякими металами та неметалами, при цьому утворюються нітриди, сполуки, в яких Нітроген проявляє ступінь окиснення –3:
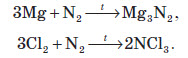
В електричному розряді азот реагує з киснем, при цьому утворюються оксиди Нітрогену II та IV. За рахунок цього під час грози повітря, а згодом і ґрунт, збагачується складними сполуками Нітрогену:

Хімічні властивості всіх алотропних модифікацій фосфору однакові, за винятком того, що білий фосфор активніший, ніж червоний, а червоний активніший, ніж чорний. Таким чином, речовину фосфор при складанні хімічних реакцій будемо записувати просто як P. Червоний і чорний фосфор реагують із киснем повітря при підвищеній температурі, а білий — навіть при кімнатній температурі:
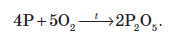
Білий фосфор при повільному окисненні киснем повітря випромінює світло. Це відбувається внаслідок того, що в процесі окиснення енергія, яка виділяється, витрачається на випромінювання світла. Це явище називають хемілюмінесценцією.
Фосфор реагує з деякими неметалами-окисниками, при цьому можуть утворюватися похідні Фосфору з різним ступенем окиснення. Це залежить від кількості речовини-окисника. При надлишку окисника утворюються сполуки Фосфору (V), а при нестачі — Фосфору (III):
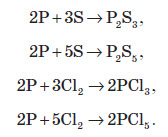
Фосфор вступає у взаємодію з багатьма активними металами. При цьому утворюються фосфіди металів. Фосфіди — це сполуки, в яких атом Фосфору виявляє ступінь окиснення –3:
Більшу частину добутого в промисловості азоту використовують для виробництва амоніаку. Багато азоту йде для виробництва нітратних добрив, які добувають із повітря при електричному розряді. За рахунок своєї інертності азот часто застосовують для створення інертної атмосфери в різних промислових процесах, для заповнення ламп розжарювання, для заповнення вільного місця в термометрах та барометрах. У металургії азот використовують при загартовуванні сталі, тому що на поверхні розпеченого металевого лиття утворюється тугоплавкий і стійкий ферум нітрид.
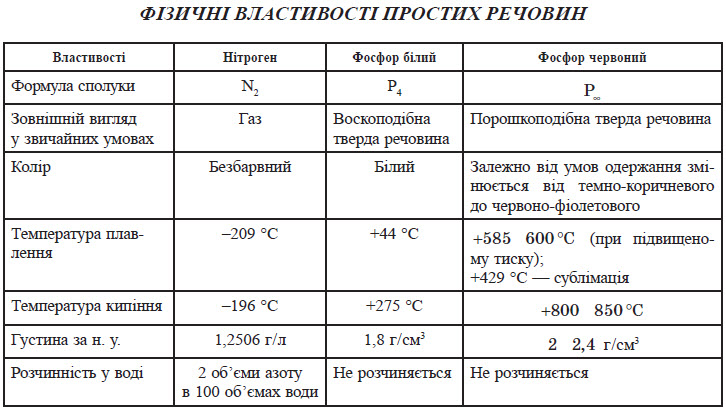
Фізичні властивості амоніаку
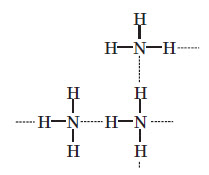
Амоніак являє собою безбарвний газ із дуже різким характерним запахом. Саме амоніак надає запаху медичному препарату, який називають «нашатирний спирт». Температури його фазових переходів дорівнюють: Тпл=–78 °С і Ткип=–33 °С. У рідкому стані між молекулами амоніаку утворюються стійкі водневі зв’язки, чим пояснюються високі температури кипіння та плавлення:
Амоніак дуже добре розчиняється у воді: при +20 °С в 1 літрі води розчиняється 700 літрів амоніаку, а при 0 °С — 1180 літрів.
Хімічні властивості амоніаку
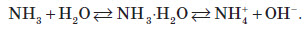
Четвертий зв’язок між Нітрогеном та Гідрогеном в йоні амонію утворюється за донорно-акцепторним механізмом. Йон амонію має форму правильної трикутної піраміди (тетраедра), у вершинах якої перебувають атоми Гідрогену, а в її центрі — атом Нітрогену.
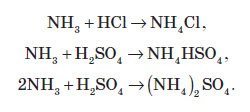
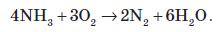
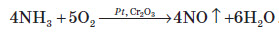
У водних розчинах відновлює бром:
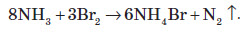
За рахунок гідролізу розчини солей амонію проявляють слабокислу реакцію:
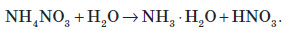
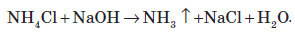
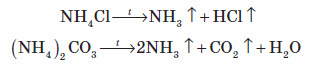
Застосування амоніаку
Амоніак переважно використовують як реагент для виробництва більш складних хімічних сполук, таких як нітратна кислота, сода, різні солі амонію. Багато амоніаку використовують для виробництва різних органічних сполук, що містять атоми Нітрогену. Сьогодні амоніак широко використовують у холодильних установках. Іноді амоніак використовують як рідке добриво.
Якісна реакція на йон амонію
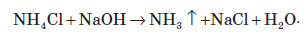
Оскільки майже всі солі амонію добре розчиняються у воді, то для виявлення амоніаку вивчають запах досліджуваного розчину, в який попередньо додають луг. У разі присутності в розчині йонів амонію, при підлуговуванні виділяється амоніак, запах якого легко виявити:
Амоніак в лабораторії одержують :
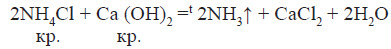
На повітрі швидко окиснюється, при цьому утворюється бурий газ:
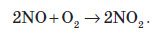
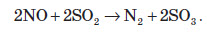
Газ реагує з водою, при цьому проходить реакція диспропорціонування:
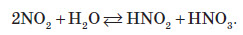
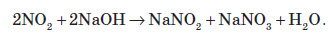
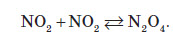
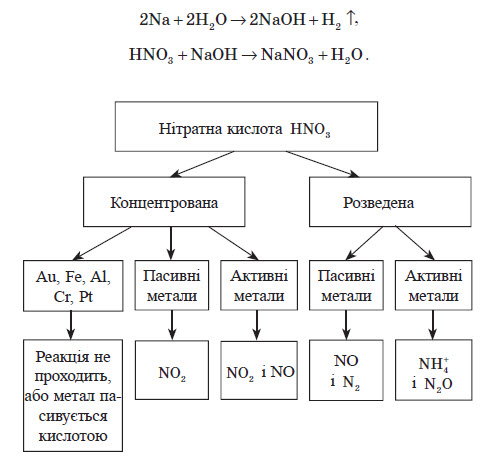
Нітратна кислота
У молекулі нітратної кислоти HNO3 Нітроген перебуває в ступені окиснення +5, але при цьому проявляє валентність, що дорівнює 4. Будова молекули нітратної кислоти зображена нижче.
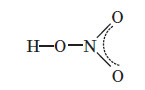
Фізичні властивості нітратної кислоти
Нітратна кислота за нормальних умов являє собою безбарвну, важку димну рідину, яка кристалізується при температурі –42 °С, а кипить при температурі +83 °С. Ця кислота має їдкий характерний запах. У твердому стані HNO3 є безбарвною кристалічною масою. При температурі близько +25 °С вона набуває червоного забарвлення унаслідок виділення бурого газу NO2 . Нітратна кислота змішується з водою в будь-яких співвідношеннях. Як і сульфатна кислота, вона енергійно поглинає вологу, тобто проявляє гігроскопічні властивості.
Хімічні властивості нітратної кислоти
Нітратна кислота — нестійка сполука. Якщо концентровану кислоту опромінювати денним світлом або нагрівати, то вона стає червоною. Це відбувається за рахунок розкладання кислоти й утворення нітроген діоксиду:
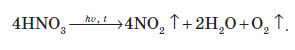
Взаємодія з металами
При взаємодії нітратної кислоти з металами водень виділяється тільки тоді, коли нітратна кислота дуже розведена (близько 1 %) й реагує з лужними металами. При цьому спочатку відбувається реакція взаємодії металу з водою, а вже потім нейтралізація утвореного лугу кислотою:
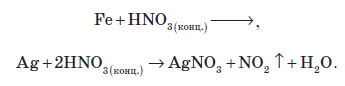
Взаємодія зі складними сполуками
Нітратна кислота вступає у взаємодію з різними складними сполуками. За рахунок проявлення кислотних властивостей, HNO3 реагує з основами та основними оксидами:
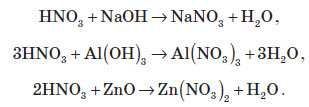
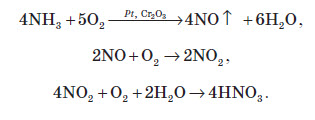
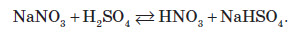
Нітрати широко використовують у народному господарстві. Амоній нітрат NH4NO3 застосовують як азотне добриво та при виробництві вибухових речовин (він входить до складу амоналу); калій нітрат KNO3 (калійна селітра) застосовують при виготовленні пороху (у чорному поросі міститься близько 75% KNO3 ) і як добриво, а ще в харчовій промисловості та при виробництві скла. Багато інших нітратів застосовують як добрива в сільському господарстві.
Усі нітрати при нагріванні розкладаються. Однак, залежно від активності металу, розклад може проходити в різних напрямках. Наприклад, нітрати металів, що перебувають в електрохімічному ряді напруг правіше магнію (літій Li, калій K, барій Ba, кальцій Ca і натрій Na), розкладаються на нітрит і кисень:
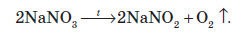
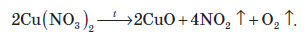
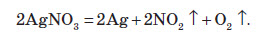
Оксиди фосфору
Фосфор (V) оксид P2O5 (фосфатний ангідрид) у звичайних умовах є білою, дуже гігроскопічною речовиною. Густина твердого фосфатного ангідриду дорівнює 2,3 г / см3 . При його нагріванні до +359 °С відбувається фазовий перехід із твердого стану в газоподібний, оминаючи рідкий. Такий фазовий перехід називають сублімацією.
Хімічні властивості фосфатного ангідриду
Фосфор (V) оксид дуже активно взаємодіє з водою. При цьому може утворюватися три кислоти: метафосфатна (HPO3), пірофосфатна (H4P2O7) або ортофосфатна (H3PO4). Продукти реакції залежать від кількості води:
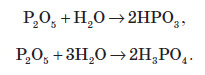
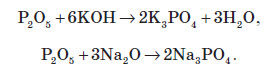
Фізичні властивості ортофосфатної кислоти
При нормальних умовах ортофосфатна кислота являє собою безбарвну й розпливчасту на повітрі кристалічну сполуку із температурою плавлення +42 °С (65 %-й розчин кислоти замерзає тільки при –85 °С). У твердому стані й у розчині молекули ортофосфатної кислоти асоційовані за рахунок водневих зв’язків, і тому концентровані розчини мають високу в’язкість.
Фосфатна кислота вступає у взаємодію з основами та основними оксидами:
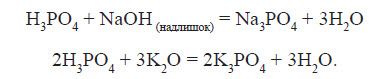
Застосування фосфатної кислоти
Фосфатну кислоту здебільшого застосовують для добування фосфатних добрив. Окрім того, її використовують у лакофарбовій, металургійній та харчовій промисловості, а також для запобігання корозії металів.
Білий фосфор
настільки активний, що горить у кисні навіть під водою. У пробірці з водою
знаходиться фосфор. Для того щоб фосфор розплавився нагріваємо пробірку у
гарячій воді. Подаємо кисень у пробірку з розплавленим фосфором. Білий фосфор
згорає з утворенням фосфорного ангідриду. У процесі горіння білий фосфор
частково перетворюється у червоний.


