Атоми Оксигену можуть утворювати два типи молекул: O2 — кисень та О3 — озон. Явище існування кількох простих речовин, утворених атомами одного хімічного елемента, називається алотропією. А прості речовини, утворені одним елементом, називають алотропними модифікаціями.
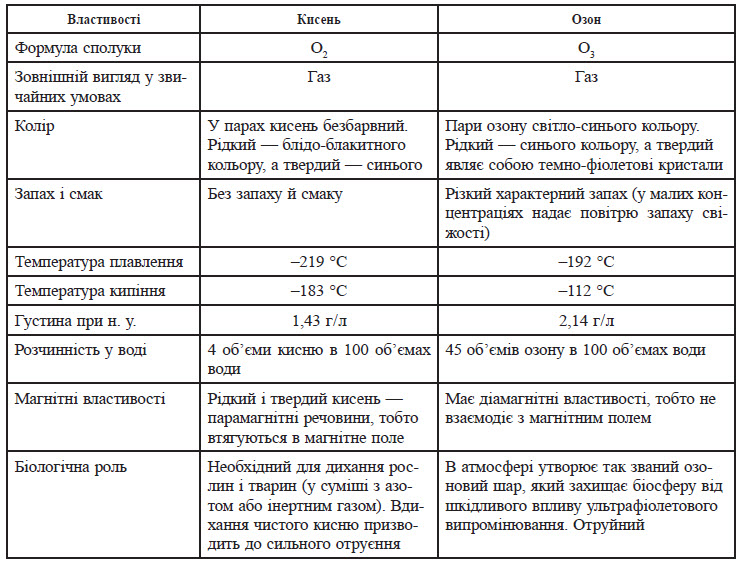
Молекулярний кисень — досить сильний окисник. Він окиснює практично всі метали (окрім золота й платини). Багато металів повільно окиснюються на повітрі, але в атмосфері чистого кисню згорають дуже швидко, при цьому утворюється оксид:
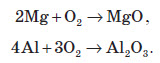
Однак деякі метали при горінні утворюють не оксиди, а пероксиди (у таких сполуках ступінь окиснення Оксигену дорівнює –1) або надпероксиди (ступінь окиснення атома Оксигену — дробова). Прикладом таких металів можуть бути барій, натрій та калій:
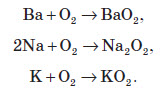
Взаємодія кисню з неметалами
Оксиген проявляє ступінь окиснення –2 в сполуках, які утворені з усіма неметалами, окрім Флуору, Гелію, Неону та Аргону. Молекули кисню при нагріванні безпосередньо вступають у взаємодію з усіма неметалами, окрім галогенів та інертних газів. В атмосфері кисню самозаймається фосфор та деякі інші неметали:
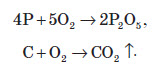
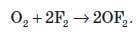
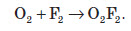
За певних умов кисень вступає у взаємодію з багатьма складними речовинами. При цьому утворюються оксиди елементів або прості речовини, утворені цими елементами:
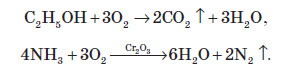
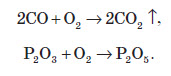
Хімічні властивості озону
Озон є більш сильним окисником, аніж молекулярний кисень. Майже всі реакції, які проходять під дією кисню, проходять також з озоном, але при цьому реакція протікає швидше й виділяється більша кількість енергії. Багато речовин під дією озону займаються:
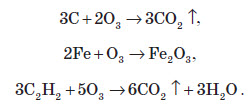
При взаємодії калію з озоном утворюється озонід (сполука йонного типу):
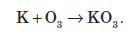
Методи добування кисню
Кисень зазвичай добувають у лабораторіях електролізом слабкого водного розчину натрій гідроксиду (електроди нікельовані):

Кисень можна добути термічним розкладанням багатих на Оксиген сполук (хлоратів, перманганатів, нітратів, пероксидів, оксидів):
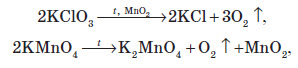
У промисловості кисень добувають із рідкого повітря. Спочатку повітря охолоджують до –200 °С, а потім поступово нагрівають. При –196 °С випаровується азот, і залишається рідкий кисень.
Кисень використовують усі аеробні живі істоти для дихання. У процесі фотосинтезу рослини виділяють кисень і поглинають вуглекислий газ.
Молекулярний кисень застосовують для так званої інтенсифікації, тобто прискорення окисних процесів у металургійній промисловості. А ще кисень використовують для добування полум’я з високою температурою. При горінні ацетилену (C2H2) в кисні температура полум’я сягає +3500 °С. У медицині кисень застосовують для полегшення дихання хворих. Його також використовують у дихальних апаратах для роботи людей у важкій для дихання атмосфері. Рідкий кисень застосовують як окисник ракетного палива.
Озон використовують у лабораторній практиці як дуже сильний окисник. У промисловості з його допомогою дезінфікують воду, оскільки йому притаманна сильна окисна дія, яка знищує різні мікроорганізми.
Пероксиди, надпероксиди та озоніди лужних металів застосовують для регенерації кисню в космічних кораблях та на підводних човнах. Таке застосування засноване на реакції цих речовин з вуглекислим газом CO2:
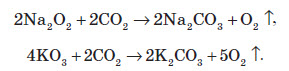
Атоми Сульфуру, так само, як і Оксигену, можуть утворювати різні алотропні модифікації ( S12; S8; S6; S2 та інші).
Усі модифікації сірки не розчиняються у воді, зате досить добре розчиняються в сірковуглеці (CS2) та деяких інших неполярних розчинниках.
Хімічні властивості сірки
Взаємодія сірки з металами
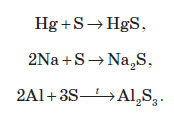
Взаємодія сірки з неметалами
Під час нагрівання сірка реагує з багатьма неметалами. При горінні на повітрі утворюється сульфур(IV) оксид:
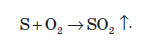
При нагріванні сірки в потоці водню утворюється сірководень. У сірководні Сульфур перебуває в ступені окиснення –2. Такий самий ступінь окиснення Сульфур проявляє й у сірковуглеці, який утворюється при взаємодії сірки й вуглецю:
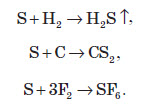
Головний продукт сірчаної промисловості — це сульфатна кислота. На її виробництво припадає близько 60 % сірки, яку видобувають. У гумотехнічній промисловості сірку використовують для перетворення каучуку у високоякісну гуму, тобто для вулканізації каучуку. Сірка — найважливіший компонент будь-яких піротехнічних сумішей. Наприклад, у сірникових головках міститься близько 5 %, а в намазці на коробці — близько 20 % сірки за масою. У сільському господарстві сірку використовують для боротьби зі шкідниками виноградників. У медицині сірку застосовують при виготовленні різних мазей для лікування шкірних захворювань.
Оксиди Сульфуру
фізичні властивості оксидів Сульфуру
Сульфур (VІ) оксид, або сульфур триоксид, або сірчаний ангідрид, утворює кілька алотропних модифікацій. Одна з них, y-SO3 , являє собою безбарвну рідину, з температурою кипіння +45 °С та температурою кристалізації –17 °С. У твердому стані ця модифікація схожа на лід. Інша модифікація — a-SO3 —кристалічна речовина, схожа на азбест, що плавиться при температурі +40 °С. Необмежено розчиняється у воді. Добре розчиняється в сульфатній кислоті. Розчин сульфур триоксиду в сульфатній кислоті називають олеумом.
Хімічні властивості оксидів Сульфуру
Pеакції без зміни ступеня окиснення
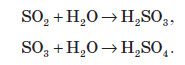
Обидві речовини є кислотними оксидами, тобто реагують із основами:
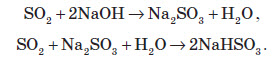
З основними оксидами:
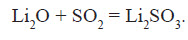
При розчиненні SO3 у сульфатній кислоті утворюється олеум:
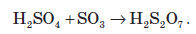
Олеум — це важливий продукт хімічної промисловості. Його використовують у виробництві лакофарбових та гумотехнічних виробів, для очищення нафти.
Сульфатна кислота
Структурна формула сульфатної кислоти має такий вигляд:
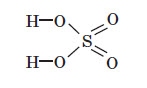
Фізичні властивості сульфатної кислоти
Сульфатна кислота — це безбарвна, важка, масляниста рідина, яка замерзає при температурі +10 °С, а кипить при температурі +296 °С (кипить 98,3 % розчин, а надлишок сульфатної кислоти розкладається на сульфатний ангідрид та воду). Густина сульфатної кислоти при +20 °С дорівнює 1,84 г / см
3. 100 % сульфатна кислота майже не проводить електричний струм. 95 %-й розчин сульфатної кислоти кристалізується при більш низькій температурі: –20 °С.
Сульфатна кислота здатна розчиняти близько 65 % сульфатного ангідриду SO3 . При цьому утворюється олеум.
Хімічні властивості сульфатної кислоти
Сульфатна кислота є дуже сильним окисником. У розведених розчинах окиснення проходить за рахунок йона Гідрогену, а в концентрованих розчинах — за рахунок атома Сульфуру(VI).
Кислотні властивості сульфатної кислоти
Сульфатна кислота — це одна з найсильніших кислот. У розведених розчинах вона являє собою двохосновну кислоту, яка піддається дисоціації за такою схемою:
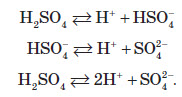
Сульфатна кислота, так само, як і сульфітна, утворює два ряди солей. До них належать сульфати (наприклад, BaSO4 — барій сульфат) та гідрогенсульфати (NaHSO4 — натрій гідрогенсульфат). Сульфатна кислота енергійно реагує з різними основами й основними оксидами, при цьому утворюються сульфати:
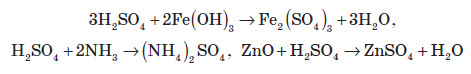
Реагує вона й з металами, які перебувають у ряді стандартних електродних потенціалів до водню:
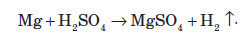
А от із залізом концентрована сульфатна кислота (75%) не реагує, тому її зазвичай перевозять у сталевих бочках та цистернах. Сульфатна кислота не реагує також і зі свинцем, оскільки поверхня металу покривається міцною плівкою нерозчинного плюмбум (ІІ) сульфату PbSO4, і на цьому процес зупиняється.
Окисні властивості сульфатної кислоти
У концентрованих розчинах при нагріванні сульфатна кислота реагує з багатьма металами, навіть із деякими з тих, які перебувають в електрохімічному ряді напруг правіше водню:
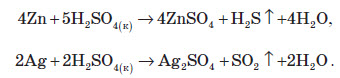
Сульфатну кислоту використовують для виробництва різних летких кислот, наприклад, хлоридної, оцтової, ортофосфатної, нітратної та інших, а також для виробництва азотних і фосфатних добрив (суперфосфату, амоній фосфату тощо). Сульфатна кислота необхідна у виробництві пластмас, паперу, будівельних матеріалів, тканин, лакофарбових виробів та мийних засобів. Її застосовують для очищення нафти, нафтопродуктів і продуктів коксохімічного виробництва (бензену й толуену) від шкідливих домішок. Для виробництва ефірів, ангідридів органічних кислот і різних сульфопохідних також необхідна сульфатна кислота. У металургійній промисловості її застосовують для очищення поверхні металів перед нанесенням по криття. Розчин сульфатної кислоти використовують як електроліт у кислотних акумуляторах.
Сульфатна кислота незамінна в народному господарстві.
Сульфати
Солі сульфатної кислоти, сульфати, зазвичай являють собою кристалічні речовини, добре розчинні у воді (окрім PbSO4 та BaSO4).
Зазвичай сульфати добувають шляхом дії на карбонати або гідрогенкарбонати металів сульфатною кислотою:
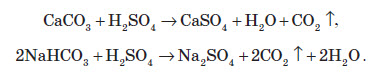
При прожарюванні сульфатів лужних і лужноземельних металів до високих температур розкладу сполуки не відбувається аж до плавлення (близько 2000 °С). При нагріванні сульфатів менш активних металів відбувається розклад на оксиди:
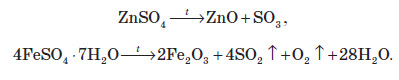
Сульфати металів, що перебувають в електрохімічному ряді потенціалів правіше водню, розкладаються на метал, сульфур оксид та кисень:
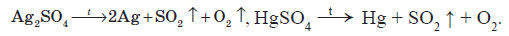
Кристалогідрати подвійних сульфатів, які містять одновалентний і тривалентний катіон, мають назву галуни. Галуни використовують як дубильний засіб у шкіряному виробництві, при виготовленні паперу, у фотографії, у медицині.
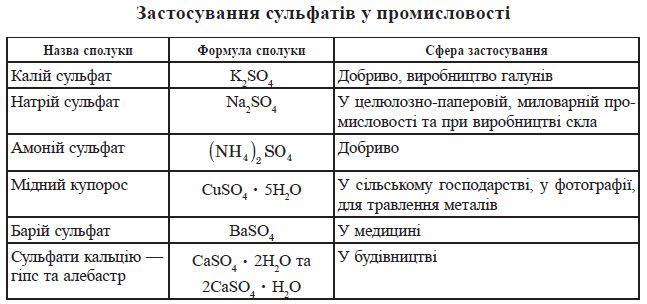
Якісна реакція на сульфат-іон
В аналітичній хімії використовують реакцію взаємодії хлориду або нітрату Барію із утворенням барій сульфату. При цьому утворюється білий дрібнокристалічний осад, який не розчиняється в кислотах та лугах:
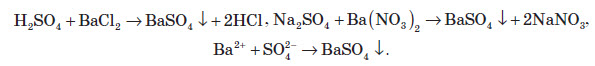
Отриманий осад розчиняється тільки в концентрованій сульфатній кислоті:
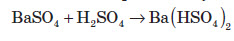
Проведемо реакцію
взаємодії сірки і цинку. Для цього візьмемо порошки обох речовин. Для того щоб
реакція почалась, необхідне нагрівання. Приготовлену суміш висипаємо на
азбестову сітку, підносимо палаючу скіпку. Реакція починається не одразу, але
протікає дуже бурхливо.


