Властивості хімічного елемента
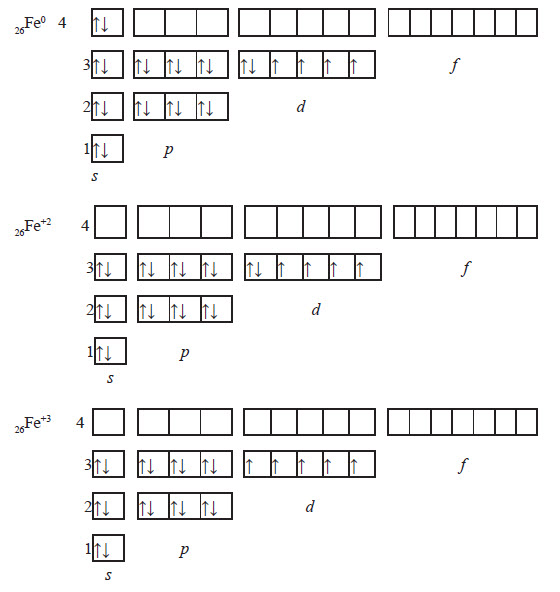
Ферум належить до металічних елементів. За будовою електронної оболонки його відносять до d-елементів, тому що в нього відбувається заповнення електронами d-підрівня.
Здебільшого Ферум виявляє ступінь окиснення +2 (за рахунок двох електронів зовнішнього рівня) або +3 (віддаючи ще один електрон з передзовнішнього рівня). Ступінь окиснення +3 для Феруму більш стабільний, оскільки перед зовнішній d-підрівень у цьому разі стає наполовину заповненим, що є більш вигідним. Ферум є досить активним елементом. У хімічних реакціях він проявляє здебільшого металічні властивості.
Здебільшого Ферум виявляє ступінь окиснення +2 (за рахунок двох електронів зовнішнього рівня) або +3 (віддаючи ще один електрон з передзовнішнього рівня). Ступінь окиснення +3 для Феруму більш стабільний, оскільки перед зовнішній d-підрівень у цьому разі стає наполовину заповненим, що є більш вигідним. Ферум є досить активним елементом. У хімічних реакціях він проявляє здебільшого металічні властивості.
Фізичні властивості заліза
Залізо є речовиною з немолекулярною будовою. У звичайних умовах залізо являє собою метал сірого кольору з металічним блиском, добре проводить електричний струм і теплоту. Залізо є досить пластичним металом і добре піддається куванню. Температура плавлення заліза +1540 °С, густина 7,87 г / см3. Як і багато інших металів, залізо не розчиняється у воді та в інших розчинниках, але розчиняється в ртуті.
Залізо притягується магнітом, тобто є парамагнетиком. Для заліза також характерне явище феромагнетизму — воно зберігає намагніченість після усунення зовнішнього магнітного поля. Завдяки цьому із заліза можна виготовляти магніти, а також матеріали для запису інформації.
Хімічні властивості заліза
Залізо досить активно вступає в хімічні взаємодії. Оскільки залізо має явні металічні властивості, то воно вступає переважно в реакції з неметалами.
Залізо активно вступає у взаємодію з киснем навіть у звичайних умовах. При нагріванні заліза на повітрі його поверхня покривається залізною окалиною:
Залізо активно вступає у взаємодію з киснем навіть у звичайних умовах. При нагріванні заліза на повітрі його поверхня покривається залізною окалиною:
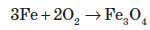
Залізний дріт також дуже активно згорає, якщо його помістити в посудину, наповнену хлором. При цьому утворюється ферум (III) хлорид:
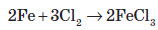
Залізо також активно взаємодіє із сіркою. У результаті цієї реакції утворюється ферум (II) сульфід:
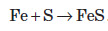
Залізо здатне реагувати з водою. При пропусканні перегрітої пари через розжарені залізні ошурки залізо перетворюється в залізну окалину й при цьому виділяється водень:
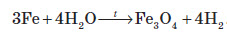
У звичайних умовах залізо активно реагує з кислотами. При цьому утворюються солі, до яких Ферум входить зі ступенем окиснення +2:
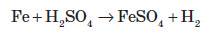
Ферум також здатен витісняти менш активні метали з розчинів солей:
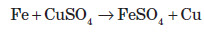
Зі ступенем окиснення +3 він може проявляти амфотерні властивості. Це можна довести тим, що ферум (III) гідроксид розчиняється в гарячому концентрованому лузі:
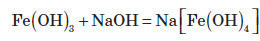
Амфотерні властивості Феруму проявляються значно слабше, ніж в Алюмінію, тому що алюміній гідроксид розчиняється в лугах у звичайних умовах, а ферум(III) гідроксид — при нагріванні й за умови високої концентрації лугу.
Застосування заліза
Залізо є одним із семи найстаріших металів — металів, відомих людству з давніх часів. Унаслідок високої хімічної активності самородне залізо (тобто у вигляді простої речовини) на Землі не зустрічається. Люди навчилися добувати залізо на початку першого тисячоліття до нашої ери. Звідтоді почався залізний вік розвитку нашої цивілізації. Хоча в археологічних розкопках іноді зустрічаються залізні вироби, датовані другим і третім тисячоліттям до нашої ери, це так зване космічне залізо — уламки залізних метеоритів, які впали на Землю.
Залізо є набагато твердішим металом, аніж мідь, тому знаряддя праці та зброю для полювання було зручніше виготовляти саме з нього. Однак для добування заліза необхідна більш висока температура вогню, ніж для добування міді. І хоча міді в земній корі міститься приблизно в 1000 разів менше, ніж заліза, її було простіше виплавляти й обробляти. Отож першим металом, який почали обробляти люди, була мідь, а не залізо.
Залізо здебільшого використовують у вигля ді сплавів: чавуну й сталі. Чавун за фізичними властивостями посутньо відрізняється від заліза: він набагато твердіший і крихкіший. Саме тому чавун не піддається куванню, однак із нього виходять предмети, які можуть витримувати великі механічні навантаження. Раніше з нього виплавляли гармати та ядра й навіть посуд. Зараз із чавуну роблять станини для верстатів, лещата та інші вироби, для яких більше важить механічна міцність, а не пластичність. Такі вироби дуже бояться ударів, від сильного удару чавун розбивається.
Широко розповсюджена іржостійка сталь, її добувають додаванням у сталь нікелю й хрому, а для добування зносостійкої сталі додають марганець (таку сталь використовують для виготовлення залізничних рейок).
FeO – компонент кераміки, пігмент для фарб і термостійкої емалі, Fe2O3 – для виготовлення кераміки, цементу, як пігмент.
Залізний купорос FeSO4*7H2O застосовують у виробництві мінеральних фарб, при фарбуванні тканин, для боротьбі з шкідниками сільського господарства.
Хлористе залізо – для отримання чистого заліза.
Fe2O3 – сполука бурого кольору, відноситься до амфотерних оксидів:
Fe2O3 – сполука бурого кольору, відноситься до амфотерних оксидів:
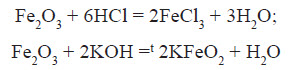
Fe(OH)2 – білого кольору, поступово зеленіє:
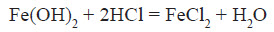
Fe(OH)3 – бурого кольору, відноситься до амфотерних основ:
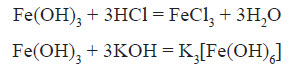
У водних розчинах сполуки Fe 2+ легко окиснюється до Fe 3+ :
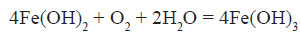
В циліндрі
знаходиться жовто-зелений газ – хлор. Розігріємо залізну дротину і опустимо у
посуд з хлором. Хлор окислює залізо до трьохвалентного.


