Маючи в зовнішньому електронному шарі тільки по одному електрону, що перебуває на порівняно великій відстані від ядра, атоми лужних елементів досить легко віддають електрон, тобто характеризуються низькою енергією йонізації.
Фізичні властивості натрію й калію
Натрій і калій — сріблясто-білі метали, що мають добру електропровідність; м’які, легші від води
Хімічні властивості натрію й калію
Натрій і калій активно взаємодіють із галогенами:
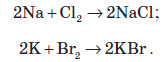
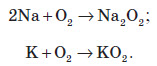
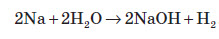
Натрій та його сплав з калієм застосовують як рідкометалеві теплоносії. У металургії натрійметричним методом добувають низку туго плавких металів, а відновлюючи натрієм KOH, виділяють калій. Окрім того, натрій використовують як зміцнювальну добавку свинцевих сплавів. В органічному синтезі натрій використовують для добування багатьох речовин. Він слугує також каталізатором при добуванні деяких органічних полімерів. Із ртуттю натрій утворює твердий сплав — амальгаму натрію, яку іноді використовують як більш м’який відновник замість чистого металу. Натрій гідроксид застосовують для очищення продуктів переробки нафти, у миловарній, паперовій, текстильній та інших галузях промисловості, а також при виробництві штучного волокна.
Кальцій
характеристика хімічного елемента
Поширеність у природі
Кальцій має велику хімічну активність, тому зустрічається в природі тільки у вигляді сполук. Найважливіші природні сполуки Кальцію:
а) вапняк, мармур, крейда (CaCO3);
б) гіпс (CaSO4*2H2O);
в) фосфорит і апатит (Ca3(PO4)2);
г) доломіт (CaCO3*MgCO3).
Фізичні властивості
Кальцій — метал сріблясто-білого кольору, дуже легкий, як і лужні метали, але значно твердіший за них і має більш високу температуру плавлення (+851 °С). Кальцій зберігають під шаром гасу.
Добування
Кальцій добувають шляхом електролізу його розплавленого хлориду.

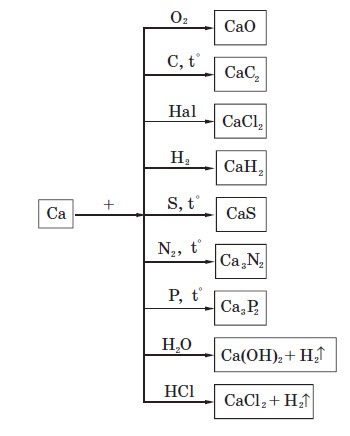
Найважливішою сполукою Кальцію є його карбонат СаCO3. Він являє собою основну складову частину вапняку, мармуру, крейди, а також входить до складу доломіту (MgCO3*СаCO3). Кальцій карбонат використовують у виробництві цементу, сталі, скла. Кальцій та кальцій карбід застосовують в органічній хімії. А ще Кальцій відіграє дуже важливу роль у біохімічних процесах, які протікають у живих організмах.
Твердість води
Твердість води — це природна властивість води, обумовлена присутністю в ній розчинених солей Кальцію та Магнію. Сумарну концентрацію йонів Магнію й Кальцію називають загальною твердістю води. Розрізняють постійну й тимчасову твердість води, їхня порівняльна характеристика подана в таблиці.

У склянки з водою
помістимо шматочки літію, натрію і калію. Калій від дотику з водою спалахує.
Натрій і літій реагують з водою менш повільно ніж калій. Поява малинового
забарвлення фенолфталеїну свідчить про утворення розчинів лугів.


