Кислоти — це складні речовини, які складаються з атомів Гідрогену, що можуть заміщатися атомами металічних елементів, та кислотних залишків.
Згідно із теорією кислот та основ Арреніуса, кислотам можна дати інше визначення, а саме: кислоти — це складні речовини, які у водних розчинах піддаються електролітичній дисоціації з утворенням йонів Гідрогену.
Найважливіші кислоти
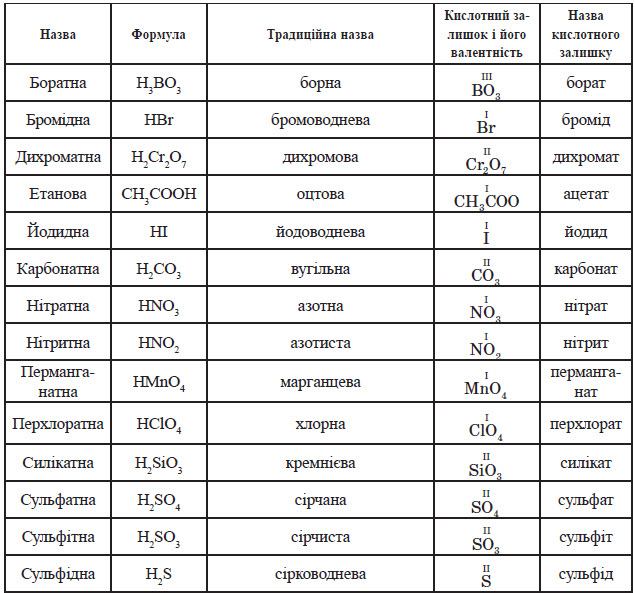

Класифікація кислот
До безоксигенових кислот належать розчини деяких газів у воді. Наприклад, хлоридна кислота —це розчин газуватого хлороводню HCl у воді, фторидна — розчин фтороводню HF, сульфідна — розчин сірководню H2S тощо.
За числом атомів Гідрогену, здатних заміщатися на атоми металічного елемента (за основні стю кислоти), кислоти поділяють на одноосновні (HCl, HNO3), двохосновні (H2S, H2SO4), трьохосновні (H3PO4) тощо.
За силою кислот, тобто за здатністю дисоціюватися на йони, кислоти поділяють на сильні, кислоти середньої сили та слабкі. До сильних кислот відносять кислоти, які в розчині з концентрацією 0,1 моль /л дисоціюють більш ніж на 30 % (сульфатна, нітратна, хлоридна тощо). Слабкі кислоти в розчинах з такою ж концентрацією дисоціюють менше ніж на 3 % (карбонатна, сульфідна, оцтова тощо). Якщо ступінь дисоціації кислоти в розчині перебуває в інтервалі 3—30 %, то її відносять до кислот середньої сили (фторидна, нітритна тощо).
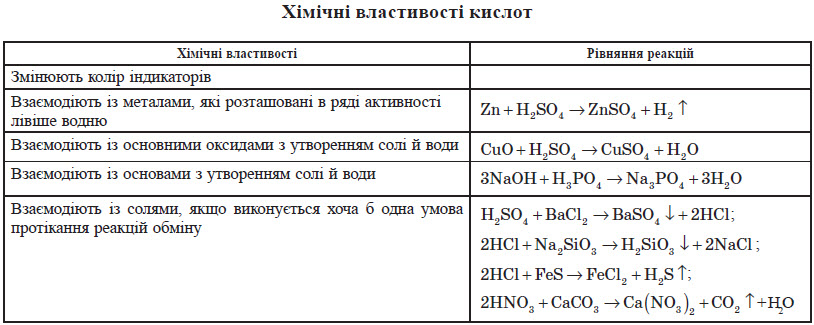

Розбавлена сульфатна кислота реагує з цинком з виділенням водню:
Zn + H2SO4 = ZnSO4 + H2


