Хімічний зв’язок — це взаємодія атомів, здійснювана шляхом обміну електронами або їхнім переходом від одного атома до іншого.
Хімічний зв’язок, що виникає внаслідок утворення спільних електронних пар, називають ковалентним.
У найпростішому з відомих атомів — атомі Гідрогену — на зовнішньому електронному рівні перебуває один електрон: при зображенні утворення хімічного зв’язку заведено позначати електрони зовнішнього енергетичного рівня (валентні електрони) крапкою або хрестиком: .Н
Такі формули називають формулами Льюїса, або електронно-крапковими формулами. За допомогою таких формул утворення молекули H2 можна записати у вигляді схеми:
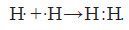
Спільну електронну пару, яка обумовлює хімічний зв’язок, можна позначити рискою. Таким чином, отримуємо структурну формулу водню:
H−H.
При взаємодії двох атомів, кожний з яких має кілька неспарених електронів, утворюється відразу кілька спільних електрон них пар. Прикладом може слугувати молекула кисню O2
O =O.
Такий хімічний зв’язок називають подвійним і позначають двома рисками. Зв’язок, утворений однією парою електронів, називають одинарним (або ординарним, тобто звичайним).
N ≡ N.
Зв’язок у молекулі азоту називають потрійним.
У молекулах водню, фтору й фтороводню між атомами утворюється ковалентний зв’язок за рахунок утворення спільної електронної пари. Атоми різних хімічних елементів здатні притягувати валентні електрони інших атомів. Однакові атоми однаково притягують електрони, тому в молекулах фторуй водню спільна електронна пара однаково притягується до обох атомів і належить їм обом однаковою мірою. Такий ковалентний зв’язок називають неполярним. У всіх простих речовинах, утворених неметалами (наприклад, H2 , N2, O2, S2), хімічні зв’язки неполярні.
Ковалентний зв’язок, утворений між атомами різних елементів, називають полярним (тому що в молекулі з’являються полюси електричного заряду). У ковалентному полярному зв’язку спільна електронна пара зміщена до того атома, який дужче притягує електрони, тобто до атома з більшою електронегативністю. Чим сильнішим є це зміщення, тим більша полярність зв’язку. Чим більшою є різниця електронегативностей, тим сильніше спільна електронна пара зміщена до більш електронегативного атома й тим більша полярність ковалентного зв’язку.
Енергія зв’язку — це кількість енергії, необхідна для розриву 1 моль однакових зв’язків. Енергія зв’язку (Е) вимірюється в кДж / моль.
Енергія зв’язку залежить, у першу чергу, від природи атомів, що утворюють зв’язок, а також від довжини зв’язку та її кратності. Чим меншою є довжина зв’язку, тим ближче розташовані атоми й тим сильніше вони взаємодіють один з одним, тим вища енергія їхнього зв’язку. У молекулах галогеноводнів від фтороводню до йодоводню довжина зв’язку збільшується, значить енергія зв’язку зменшується: від найбільш сильної у фтороводню до найбільш слабкої в йодоводню.
Енергія зв’язку залежить також від його кратності: потрійний зв’язок міцніший за подвійний, а подвійний міцніший, ніж одинарний.
При взаємодії двох атомів, один з яких віддає електрон, а інший його приймає, електрон переходить від одного атома до іншого. Атом, що віддав електрон, перетворюється на позитивно заряджений йон (катіон), а атом, що прийняв електрон,— на негативно заряджений йон (аніон).
Хімічний зв’язок, що виникає в результаті притягування протилежно заряджених йонів, називається йонним.
Йонний зв’язок утворюється між атомами елементів з великою різницею між їхніми значеннями електронегативностей, зазвичай між атомами типових металічних і неметалічних елементів. Умовно вважають, що зв’язок є йонним, якщо різниця електронегативностей двох елементів перевищує 2.
Якщо ж різниця між електронегативностями елементів менша, аніж 2, то зв’язок вважають ковалентним полярним.
Йонний зв’язок характерний для основних оксидів, лугів та солей.
Ступінь окиснення — це умовний заряд на атомі в молекулі або кристалі, який би виник на ньому,коли б усі полярні зв’язки, утворені ним, мали йонний характер.
На відміну від валентності, ступінь окиснення може бути позитивним, негативним або дорівнювати нулю.
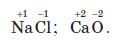
Ступінь окиснення й валентність — споріднені поняття. У багатьох сполуках абсолютна величина ступеня окиснення елементів збігається з їхньою валентністю. Однак існує чимало випадків, коли валентність відрізняється від ступеня окиснення.
У простих речовинах — неметалах існує ковалентний неполярний зв’язок, спільна електронна пара не зміщується до жодного з атомів, тому ступінь окиснення елементів у простих речовин завжди дорівнює нулю. Але атоми один з одним зв’язані, тобто проявляють певну валентність, як, наприклад, у кисні валентність Оксигену дорівнює ІІ, а в азоті валентність Нітрогену — ІІІ:
O =O, N ≡ N.
У молекулі гідроген пероксиду валентність Оксигену також дорівнює ІІ, а Гідрогену — І:
H− O − O −H.
Але ступінь окиснення Оксигену в цій сполуці дорівнює – 1.
Будь-яка молекула електронейтральна, тому сума ступенів окиснення атомів усіх елементів повинна дорівнювати нулю.
Розгляньмо це на прикладі калій сульфату K2SO4. Ступінь окиснення Калію в сполуках може бути тільки +1, а Оксигену –2:
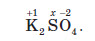
Із принципу електронейтральності обчислюємо ступінь окиснення Сульфуру:
2 (+1) + 1 (х) + 4 (–2) = 0, звідки х = +6.
При визначенні ступенів окиснення елементів у сполуках слід дотримуватися таких правил:
1. Ступінь окиснення елемента в простій речовині дорівнює нулю.
2. Флуор — найбільш електронегативний хімічний елемент, тому ступінь окиснення Флуору у всіх сполуках дорівнює –1.
3. Оксиген — найбільш електронегативний елемент після Флуору, тому ступінь окиснення Оксигену у всіх сполуках, окрім фторидів, негативний: у більшості випадків він дорівнює –2, а в пероксидах –1.
4. Ступінь окиснення Гідрогену в більшості сполук дорівнює +1, а в сполуках з металічними елементами (гідридах) –1.
5. Ступінь окиснення металів у сполуках завжди позитивний.
6. Більш електронегативний елемент завжди має негативний ступінь окиснення.
7. Сума ступенів окиснення всіх атомів у молекулі дорівнює нулю.
Металічний зв’язок має схожі риси з іншими видами хімічного зв’язку — йонного та ковалентного. Спільність електронів різних атомів металів та утворення спільної електронної хмари є ознаками подібності металічного зв’язку з ковалентним. Однак у металах ці електрони не належать окремим атомам, а є спільними для всіх атомів у межах одного кристала. Це істотно відрізняє металічний зв’язок від ковалентного. Атоми металів у металічних кристалах існують у вигляді позитивно заряджених йонів, утримувані в простій речовині хмарою спільних електронів. Цим металічний зв’язок нагадує йонний. Проте в йонному кристалі існують і позитивно, і негативно заря джені йони, а в металічному тільки позитивно заряджені, заряд яких компенсується електронами.
Переважній більшості твердих речовин притаманна кристалічна будова. Кожна кристалічна речовина має певну, характерну для неї форму кристалів. Якщо кристалічну речовину подрібнити, то її кристали розпадуться на окремі шматочки, кожен з яких зберігатиме, хоча б частково, форму вихідного кристала.
Залежно від характеру частинок, які утворюють кристал, і від типу хімічного зв’язку між ними розрізняють чотири типи кристалічних ґраток: металеву, йонну, молекулярну та атомну.
У металічних структурах електрони вільно пересуваються по всьому кристалу й у такий спосіб обумовлюють зв’язок між усіма позитивними йонами в кристалі. Завдяки такій поведінці електронів метали проявляють добру електро- і теплопровідність.
Якщо у вузлах кристалічної ґратки розташовані йони, то таку решітку називають йонною. Різнойменно заряджені йони, які утворюють йонні кристали, утримуються вкупі електростатичними силами. Тому структура йонної кристалічної ґратки повинна забезпечувати їхню електричну нейтральність.
Йонні кристалічні ґратки характерні для речовин із йонним зв’язком.
Речовини з йонною кристалічною ґраткою мають порівняно високу твердість. Вони нелеткі, тому не мають запаху.
Електричний струм проводять не тільки їхні розплави, але й розчини. Багато йонних сполук легко розчиняються у воді.
У вузлах молекулярних кристалічних ґраток розташовані молекули, які зв’язані між собою слабкими міжмолекулярними силами.
Молекулярну структуру має ще цілий ряд неорганічних сполук (наприклад, твердий амоніак), а також більшість органічних сполук (наприклад, твердий метан, етиловий спирт, бензол, фенол, нафталін тощо). Молекулярні структури можуть утворювати речовини тільки з ковалентними зв’язками.
Деякі з молекулярних речовин при нагріванні можуть переходити з твердого в газоподібний стан, оминаючи рідкий (піддаються сублімації), наприклад йод, вуглекислий газ, нафталін.
Усі атоми в атомних структурах міцно зв’язані один з одним ковалентними зв’язками. Щоб їх зруйнувати, необхідна дуже велика кількість енергії. Саме тому речовини з атомною кристалічною ґраткою мають дуже високі температури плавлення й кипіння. Вони нерозчинні у воді та в інших розчинниках.
Атомну кристалічну ґратку має алмаз — найтвердіша речовина серед усіх відомих речовин.
Графіт також має атомну кристалічну ґратку, але, на відміну від алмазу й кварцу, у графіті кожний атом Карбону утворює три ковалентні зв’язки з трьома іншими атомами Карбону; при цьому утворюється плоска «сітка із шестикутників».
На відміну від алмазу, графіт добре проводить електричний струм, але його електрони можуть пересуватися тільки в одному напрямку: вздовж площини шестикутників, а навпаки — у перпендикулярному напрямку — графіт майже не проводить електричний струм.


