Оксиди — це складні речовини, що складаються з атомів двох хімічних елементів, один з яких Оксиген.Символ елемента Оксигену завжди записують на другому місці. Назви оксидів складаються з двох слів: перше — назва хімічного елемента, який утворює оксид, у називному відмінку, а друге — слово «оксид». Якщо елемент виявляє постійну валентність, то в назві оксиду його валентність не вказують:
Al2O3 — алюміній оксид.
Якщо елемент може виявляти різні валентності й утворювати кілька оксидів, то в назві оксиду після назви елемента вказують значення його валентності римською цифрою в дужках:
CO2 — карбон (IV) оксид;
SO2 — сульфур (IV) оксид;
SO3 — сульфур (VI) оксид.
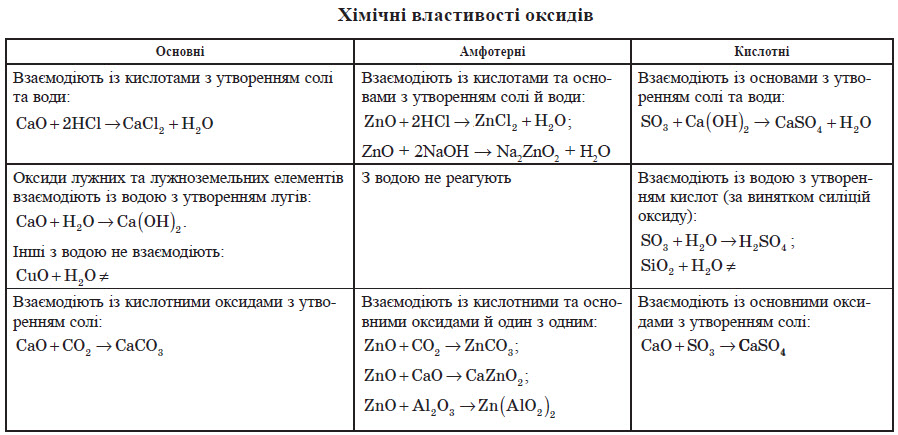
Оксиди, яким відповідають кислоти, називають кислотними оксидами.
Добування оксидів
Найбільш простий спосіб добування оксидів — це взаємодія простих речовин з киснем:
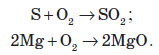
Майже всі прості речовини взаємодіють із киснем. Багато з них взаємодіють досить бурхливо, з виділенням великої кількості теплоти й світла, тобто горять.
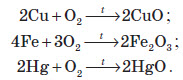
Деякі прості речовини взагалі не реагують із киснем. Серед металів — це платина й золото, а серед неметалів — інертні гази (неон, аргон тощо) і галогени (хлор, бром, йод).
Велика кількість складних речовин також здатні горіти в кисні. Під час горіння складної речовини утворюються оксиди всіх елементів, з яких складається ця речовина. Наприклад, унаслідок горіння метану CH4 утворюються два оксиди: карбон (IV) оксид та гідроген оксид:
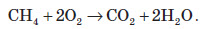
Для промисловості велике значення мають реакції згорання сульфідів металів, тому що під час цих реакцій утворюються два цінних оксиди — сульфур (IV) оксид та оксиди металічних елементів. Останні використовують для добування чистих металів:

З киснем також можуть взаємодіяти деякі оксиди.

Оксиди можна добувати також розкладанням (дегідратацією) гідратів оксидів: гідратів кислотних оксидів (кислот) та гідратів основних оксидів (гідроксидів):
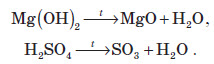
Оксиди також утворюються при розкладанні деяких солей оксигеновмісних кислот. При прожарюванні багатьох таких солей утворюються два оксиди: основний і кислотний (ангідрид кислоти, залишок якої утворює сіль).
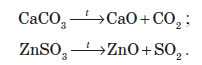
Розкладанню при прожарюванні не піддаються солі Натрію та Калію. При нагріванні вони починають плавитися, а якщо й розкладаються, то за іншим принципом. Деякі із цих реакцій використовують у лабораторії для добування кисню:
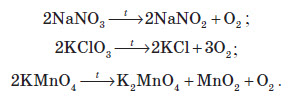
Візьмемо оксиди
кремнію і фосфору. Це кислотні оксиди. Якщо кислотний оксид реагує з водою,
утворюється кислота, але не будь-який кислотний оксид може реагувати з водою.
Оксид фосфору і вода взаємодіють, утворюючи фосфорну кислоту. Лакмус червоніє у
кислому середовищі. Оксид кремнію, навіть при нагріванні не взаємодіє з водою. Лакмус не змінює кольору, кислота не утворюється.


