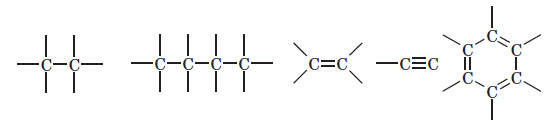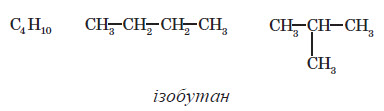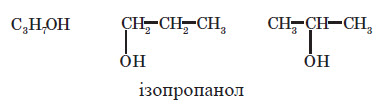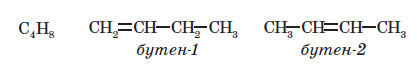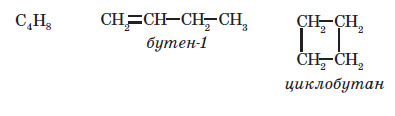Основою органічних сполук є Карбон. На відміну від інших хімічних елементів, властивості атомів Карбону дозволяють йому утворювати величезну кількість сполук, різноманітних за властивостями і функціями, які вони можуть виконувати. Різноманіття органічних сполук пояснюється двома важливими властивостями Карбону:
— здатністю атомів Карбону утворювати між собою міцні хімічні зв’язки, тобто з’єднуватися в досить довгі ланцюжки або цикли;
— здатністю атомів Карбону утворювати різні зв’язки: одинарні, подвійні і потрійні:
Незважаючи на все різноманіття, органічні сполуки мають деякі спільні властивості. Майже всі вони мають молекулярну будову, тобто складаються з молекул. Для таких сполук характерні порівняно низькі температури плавлення і кипіння, тому багато органічних сполук за звичайних умов є газуватими, леткими рідинами або легкоплавкими твердими речовинами. На відміну від більшості неорганічних сполук органічні речовини, як правило, горючі і при нагріванні розкладаються. Багато з них нерозчинні у воді, а водні розчини розчинних речовин практично не проводять електричного струму. Це говорить про те, що для органічних молекул характерні ковалентні неполярні або слабополярні хімічні зв’язки. При повному спалюванні органічних речовин утворюються вуглекислий газ і вода. Отже, більшість органічних сполук, крім Карбону, містять також атоми Гідрогену і також, можливо, Оксигену. При розпаді білків утворюється амоніак, отже, органічні речовини також можуть містити атоми Нітрогену. Ці чотири елементи — Карбон, Гідроген, Оксиген, Нітроген — утворюють більшість органічних сполук. Крім того, органічні речовини можуть містити атоми Сульфуру, Фосфору й елементів-галогенів.
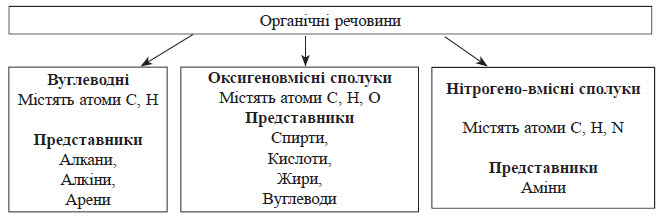
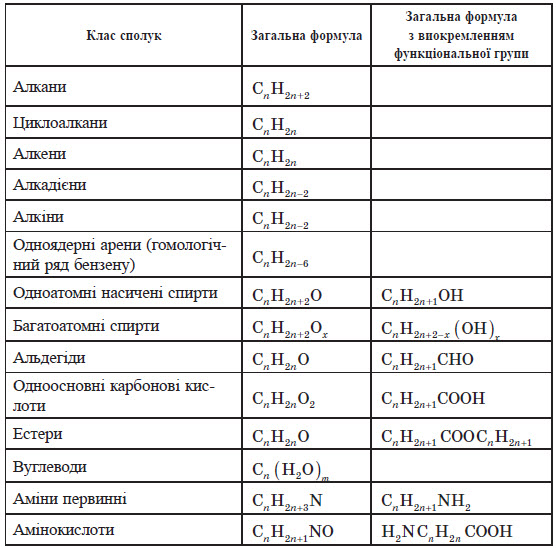
Класифікація органічних сполук
Класифікація органічних сполук за складом
Для вивчення органічних речовин зручно розділити їх на окремі класи відповідно будові або властивостям. Найпростіші органічні сполуки містять тільки два елементи — Карбон і Гідроген, їх називають вуглеводнями (від двох слів — вуглець і водень). У складніших за складом речовинах зазвичай є атоми Оксигену або Нітрогену. Класифікація органічних сполук за будовою карбонового скелету
Для складання більш детальної класифікації необхідно звернутися до будови органічних сполук. У другій половині XIX ст. німецький хімік Фрідріх Кекуле встановив, що основою кожної органічної молекули є карбоновий ланцюг, або карбоновий кістяк, що являє собою послідовність хімічно зв’язаних між собою атомів карбону. У багатьох реакціях карбоновий кістяк молекули залишається незмінним.
Карбонові ланцюги бувають циклічними — у них карбоновий ланцюг замкнутий у цикл, і відкриті, або ациклічні (приставка а — означає заперечення),— карбоновий ланцюг не замкнутий.
Органічні сполуки можна також розділити за кратністю зв’язку. Сполуки, що містять тільки одинарні зв’язки С—С, називають насиченими. Ця назва пов’язана з тим, що вони містять максимально можливе при даному кістяку число атомів Гідрогену, тобто як би насичені Гідрогеном. Сполуки зі зв’язками C=С або C = C називають ненасиченими.
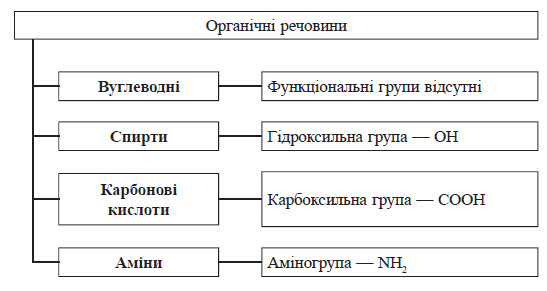
Класифікація органічних сполук за функціональними групами
Хімічні властивості органічних речовин ви значаються не тільки будовою карбонового кістяка, алеі головним чином видом атомів, які з ним зв’язані. У вуглеводнях карбоновий кістяк з’єднаний тільки з атомами Гідрогену, а в складніших молекулах — з атомами інших елементів або групами атомів, які називають функціональними групами.
Функціональні групи — це активні центри органічних молекул. Caме вони найчастіше перетерплюють хімічні перетворення, тим самим ви значаючи багато хімічних властивостей (функції) органічних сполук. Від функціональних груп залежить належність органічної речовини до того або іншого класу.
Хімічна структура та хімічна будова
Перший постулат Бутлерова. У молекулах речовин існує певний порядок зв’язування атомів, що називається хімічною структурою, або будовою речовини.
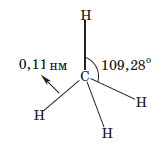
При рентгеноструктурному аналізі метану було з’ясовано, що довжина зв’язків C−H дорівнює 0,11 нанометрів (1 нм дорівнює 10 -9 метра), а з погляду стереометрії було з’ясовано, що кут �HCH дорівнює 109,28°.
Отже, наочно будову молекули метану можна подати так:
У принципі, і в більш складних органічних молекулах, в яких атоми Гідрогену заміщені різними замісниками, кути й довжини зв’язків будуть прагнути до наведених вище значень, тобто ланцюжок атомів Карбону (довжина C − C зв’язку дорівнює 0,154 нм) буде не лінійним, а зигзагоподібним.
Другий постулат Бутлерова. Хімічні реакційні здатності певних груп атомів суттєво залежать від їхнього хімічного оточення, тобто від того, з якими атомами або групами атомів сусідить певна група.
Як випливає з першого постулату Бутлерова, в органічній хімії важлива не тільки кількість тих чи інших атомів у молекулі, а ще й порядок їхнього зв’язування, тобто молекулярні формули не завжди доцільно використовувати для органічних сполук.
Гомологічні ряди органічних сполук
Сполуки одного класу, що мають подібну будову, але відрізняються за складом на одну або кілька груп CH2, називають гомологами.
Групу CH2 називають гомологічною різницею. Сукупність всіх гомологів утворює гомологічний ряд.
Третій постулат Бутлерова. Деякі різні речовини мають однакову хімічну формулу, але різну структуру. Таке явище називають ізомерією. Ізомери
Одній молекулярній формулі можуть відповідати різні речовини. Наприклад, для сполуки зі складом C4H10 можна запропонувати дві структурні формули, в яких карбоновий кістяк буде містити чотири атоми, з’єднані один з одним двома різними способами:
Кожному з них відповідає свій вуглеводень:
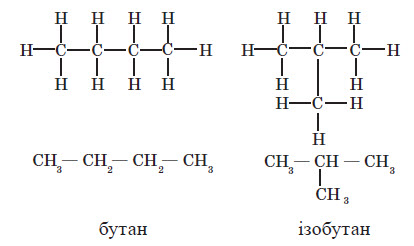
Таким чином, одній молекулярній формулі відповідають дві різні речовини — їх називають ізомерами.
ізомери — це речовини, що мають однакову молекулярну формулу, але різну будову.
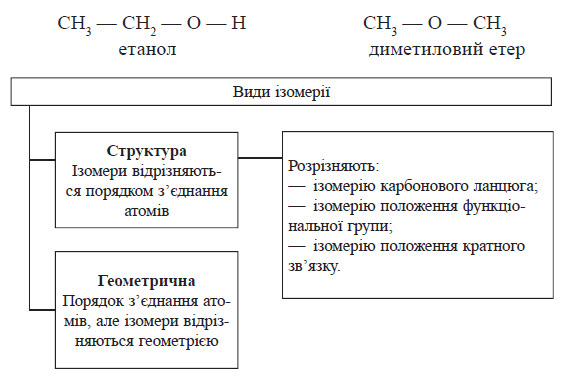
Будова молекул визначає їхні властивості, тому ізомери відрізняються один від одного за фізичними і хімічними показниками. Наприклад, складу C2H6O відповідають дві речовини — етанол і диметиловий етер:
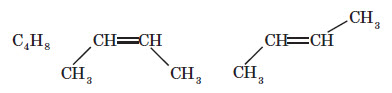
Усі різновиди ізомерії можна згрупувати у два типи: структурна і геометрична. Структурні ізомери відрізняються один від одного порядком з’єднання атомів, а у геометричних ізомерів порядок з’єднання однаковий, але геометрично молекули відрізняються одна від одної, наприклад:
Найчастіше трапляється ізомерія карбонового ланцюга: в цьому випадку ізомери відрізняються порядком з’єднання атомів Карбону карбонового кістяка, як, наприклад:
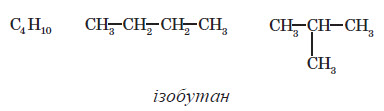
Багато сполук містять у своєму складі функціональні групи. Якщо карбоновий ланцюг має достатню довжину, то функціональна група може з’єднуватися з різними атомами Карбону в ланцюзі — це ізомерія положення функціональної групи:
Якщо сполука з великим карбоновим ланцюгом також має кратні зв’язки (подвійні або по трійні), то такі зв’язки можуть бути утворені між різними атомами Карбону — це ізомерія положення кратного зв’язку:
Структурні ізомери можуть належати не тільки до одного, але і до різних класів сполук. У такому випадку ізомерію називають міжкласовою.
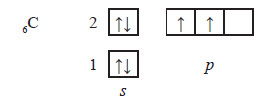
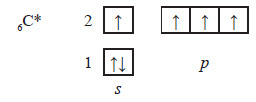
В молекулах насичених вуглеводнів існує два типи зв’язків: С—С — ковалентний неполярний і С—Н — ковалентний слабополярний. У всіх органічних сполуках атоми Карбону утворюють по чотири хімічні зв’язки. Валентність атома Карбону має обумовлюватися будовою його електронної оболонки. У звичайному (основному стані) на зовнішньому енергетичному рівні атома Карбону міститься 4 електрони: одна пара на s‑орбіталі і два неспарені на p-орбіталях: Але для утворення чотирьох зв’язків на зовнішньому рівні має бути чотири неспарені електрони.
Для цього атом Карбону поглинає невелику кількість енергії і переходить у збуджений стан, в якому будова його електронної оболонки виявляється наступною:
Під час переходу одного електрона на p-орбіталь орбіталі зовнішнього рівня атома карбону також змінюються: одна s‑орбіталь та три p-орбіталі утворюють чотири однакові за енергією та формою орбіталі:
Ці орбіталі називають гібридизованими, а про стан самого атома Карбону говорять, що він перебуває у стані sp3-гібридизації. Оскільки нові орбіталі однакові за енергією, вони мають однаково відштовхуватися одна від одної і тому, на відміну від звичайних p-орбіталей, які розташовані по взаємноперпендикулярних вісях, sp3-гібридизовані орбіталі у просторі розташовані таким чином, що вони спрямовані до вершин тетраедра (правильної трикутної піраміди). В молекулах ненасичених вуглеводнів атоми Карбону також чотиривалентні, але хімічні зв’язки вони утворюють не чотирма іншими атомами, а з меншою кількістю. Тому атоми Карбону також мають бути в певному стані гібридизації. В молекулі етилену атоми Карбону з’єд нуються з трьома атомами: два атоми Гідрогену і один атом Карбону. Для утворення такого числа зв’язків атом Карбону перебуває в стані sp2-гібридизації.
У такому стані в атома Карбону є три sp2-гібридизовані орбіталі, що розташовані в одній площині під кутом 120° одна до одної. А одна p-орбіталь, що не бере участі в гібридизації, розташована перпендикулярно до площини гібридизованих орбіталей.
На відміну від етилену, в ацетилені атоми Карбону перебувають у стані sp-гібридизації. В такому стані в атома є тільки дві гібридизовані орбіталі, що розташовані на одній лінії, тобто під кутом 180 °:
А дві p-орбіталі, що не беруть участі в гібридизації, розташовані взаємно перпендикулярно до гібридизованих орбіталей.
H – C = C – H
Зверніть увагу, що молекула ацетилену є лінійною: всі атоми розташовані на одній прямій. І зі збільшенням кратності зв’язку зменшується його довжина: якщо в алканах довжина зв’язку С—С
становить 0,154 нм, в алкенах зв’язок С=С має довжину 0,133 нм, то в ацетилені потрійний зв’язок вже 0,121 нм.
Атом Карбону утворює � -зв’язок за рахунок перекривання гібридних орбіталей (sp3-, sp2- або sp-атомних орбіталей) з гібридними орбіталями іншого атома Карбону або будь-якими орбіталями атомів інших елементів. Перекривання здійснюється таким чином, що область максимальної електронної густини зосереджується в просторі між ядрами на прямій, що з’єднує центри атомів. Таке перекривання виявляється найбільш ефективним, а � б-зв’язки, які при цьому виникають, — найбільш міцними.
Номенклатура вуглеводнів
За правилами ІЮПАК, назву органічної сполуки вибудовують із назви головного ланцюга, який утворює корінь слова, та назви функцій, використовуваних як префікси або суфікси.
Для правильної побудови назви необхідно провести вибір головного ланцюга та нумерації атомів Карбону в ньому.
У замісній номенклатурі назва сполуки являє собою складене слово, корінь якого включає назву родоначальної структури. Назви замісників позначають префіксами (приставками) і суфіксами.
Замісник — це будь-який атом або група атомів, що заміщають атом Гідрогену в родоначальній структурі. Функціональна група — це атом або група атомів невуглеводневого характеру, які визначають приналежність сполуки до певного класу. Характеристична група — це функціональна група, пов’язана з родоначальною структурою.
Для побудови назви в першу чергу визначають тип характеристичної групи (якщо вона присутня).
Коли характеристичних груп у сполуці кілька, то виділяють старшу характеристичну групу. Потім визначають родоначальну структуру, до якої має обов’язково входити старша характеристична група.
При складанні назв насичених вуглеводнів слід дотримуватися правил, які ми подаємо нижче.
Нумерацію атомів Карбону в головному ланцюзі починають із того кінця ланцюга, до якого ближче розташована старша група. Якщо таких можливостей виявляється кілька, то нумерацію проводять
таким чином, щоб або кратний зв’язок, або інший замісник, наявний у молекулі, одержали найменший номер.
Основу назви сполуки становить корінь слова, який позначає насичений вуглеводень із тим же числом атомів, що й головний ланцюг (наприклад, мет-, ет-, проп-, бут-, пент-, гекс- тощо). Потім іде суфікс, який характеризує ступінь насиченості, -ан, якщо в молекулі немає кратних зв’язків, -ен (-єн) — при наявності подвійних зв’язків та -ин (-ін) — для потрійних зв’язків, наприклад пентан, пентен, пентин. Якщо кратних зв’язків у молекулі кілька, то в суфіксі вказують число таких зв’язків, наприклад: -дієн, -триєн, а після суфікса обов’язково арабськими цифрами вказують положення кратного зв’язку.
Далі в суфікс виносять назву найстаршої характеристичної групи в молекулі із зазначенням її положення цифрою. Інші замісники позначають за допомогою префіксів. При цьому їх наводять не за порядком старшинства, а за абеткою. Положення замісника позначають цифрою перед префіксом, наприклад: 3-метил; 2-хлор тощо. Якщо в молекулі є кілька однакових замісників, то перед назвою відповідної групи словом указують їхню кількість (наприклад, диметил-, трихлор- тощо).
Усі цифри в назвах молекул від окремлюють від слів дефісом, а один від одного комами. Вуглеводневі радикали мають свої назви. Назва вуглеводневого радикала походить від назви відповідного йому алкану заміною суфікса — -ан на -ил. Наприклад, СН4 — метан, а радикал СН3 — називається метил, С2Н5 — етил тощо.