Галогени містяться у головній підгруппі VII групи Періодичної система хімічних елементів.
Формули простих речовин: F2,Cl2, Br2, I2, At2
Найголовніші сполуки галогенів: Гідроген хлорид – HCl, фториди металічних елементів: CaF2 –флюорит (кальцій фторид). Na3AlF6 – кріоліт, NaCl – харчова сіль
NaCl ∙ KCl – сильвініт
KBr – калій бромід
KI – калій йодид
Хлориди, броміди і йодиди в більшості випадків розчинні в воді сполуки, а фториди — лише частина. Здатність більш активних галогенів витісняти менш активні галогени з їхніх сполук використовують на практиці: 2KBr + Cl2 = 2KCl + Br2
F2 – є самий активний неметал і галоген. Активність від фтору до йоду знижується. Хімічні властивості галогенів подібні до хімічних властивостей хлору.
F2 – є самий активний неметал і галоген. Активність від фтору до йоду знижується. Хімічні властивості галогенів подібні до хімічних властивостей хлору.
Хімічні властивості хлору:
1. Взаємодія з металами:
2Na +Cl2 = 2NaCl
2. Взаємодія з неметалами:
H2 + Cl2 = 2HCl;
2P + 3Cl2 = 2PCl3;
2P + 5Cl2 = 2PCl5
Безпосередньо не реагує з O2, C, N2
3. Взаємодія з водою:
Cl2 + H2O = HCl + HСlO
Використання: для відбілювання паперу, тканини, дизенфекції питної води, для виробництва отрутохімікатів, хлоридної кислоти, хлорорганічних сполук .
Хлорнуватиста кислота – сильний окисник. Вона легко розкладається: HСlO → HCl + O
В лабораторії гідроген хлорид добувають за реакцією обміну між твердою сіллю і концентрованою сульфатною кислотою:
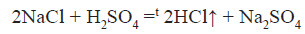
Хлороводень розчиняється у воді і отримують хлоридну кислоту.
Гідроген хлорид:
— за звичайних умов не реагує з металами та їх оксидами;
— реагує з водою, з утворенням хлоридної кислоти;
— реагує з органічними сполуками;
— застосовуються для виробництва хлоридної кислоти ,пластмас, каучуку, органічних розчинників.
Хлоридна кислота
Хімічні властивості:
1) Діє на індикатори
2) Взаємодіє з металами; які розміщуються до Н2 в ряду активності металів.
2) Взаємодіє з металами; які розміщуються до Н2 в ряду активності металів.
2HCl + Zn = ZnCl2 + H2↑.
3) взаємодія з основними і амфотерними оксидам:
2HCl + CaO → CaCl2 + H2O.
4) Взаємодія з основами:
2HCl + Cu(OH)2 → CuCl2 + 2H2O.
5) Взаємодія з солями:
2HCl + CaCO3 = H2O + CO2↑ + CaCl2.
6) Якісна реакція для виявлення хлорид-іонів:
Аргентум нітрат с реактивом на соляну кислоту і її солі – випадає білий сирнистий осад, який не розчиняється ні у воді ні в кислотах.
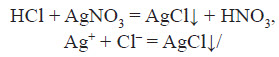
Застосування хлоридної кислоти:
добування солей, при паянні, очищення поверхні металів, у гальваностегії, добування фарб, добування ліків, добування пластмас та інших полімерів.


