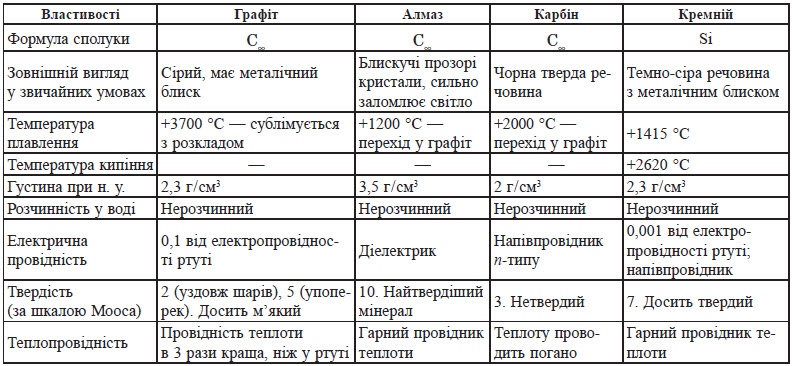
Фізичні властивості простих речовин
Вуглець не розчиняється ні в кислотах, ні в лугах, і тільки концентровані сульфатна та нітратна кислоти окиснюють вуглець до карбон діоксиду.
При нормальних умовах роздроблений на порошок графіт реагує тільки з фтором, а при високих температурах відбувається реакція з киснем і сіркою та воднем, при цьому в більшості випадків утворюються сполуки чотиривалентного Карбону:
А коли кисню не вистачає, утворюється карбон монооксид:
При сплавлянні з деякими металами утворюються карбіди:
Вуглець є гарним відновником. Наприклад, його використовують для добування деяких металів з їхніх оксидів та деяких солей: Хімічні властивості кремнію
Кремній є досить інертною речовиною за рахунок високої енергії кристалічної ґратки. При кімнатній температурі силіцій реагує тільки з фтором:
При більш високих температурах кремній реагує з хлором, киснем, азотом та вуглецем. При цьому утворюються, відповідно, хлорид, оксид, нітрид та карбід силіцію:
При сплавлянні кремнію з металами утворюються сполуки, аналогічні до карбідів — силіциди:
Застосування вуглецю
Вуглець є однією з найпотрібніших корисних копалин на нашій планеті. Вуглець переважно використовують як паливо для енергетичної промисловості. Щорічний видобуток кам’яного вугілля у світі становить близько 550 мільйонів тонн. Окрім використання вугілля як теплоносія, чималу його кількість переробляють у кокс, необхідний для добування різних металів. На кожну тонну отриманого заліза в результаті доменного процесу витрачають 0,9 тонн коксу. Активований вуглець застосовують у медицині при отруєннях та в протигазах.
Графіт у великих кількостях використовують для виготовлення олівців. Добавка графіту до сталі збільшує її твердість та стійкість щодо стирання. Таку сталь використовують, наприклад, для виробництва поршнів, колінчастих валів та деяких інших механізмів. Здатність структури графіту до розшаровування дозволяє застосовувати його як високоефективну змазку при дуже високих температурах (близько +2500 °С).
Графіт має іще одну дуже важливу властивість — він є ефективним уповільнювачем теплових нейтронів. Цю властивість використовують в ядерних реакторах. Останнім часом стали користуватися пластмасами, в які як наповнювач додають графіт. Властивості таких матеріалів дозволяють використовувати їх для виробництва багатьох важливих пристроїв та механізмів.
Алмази використовують як гарний твердий матеріал для виробництва таких механізмів, як шліфувальні круги, склорізи, бурові установки та інші прилади, які потребують високої твердості. Красиво ограновані алмази застосовують як дорогі прикраси, які називають діамантами.
Карбон (II) оксид
Чадний газ являє собою безбарвний газ із досить низькими температурами плавлення та кипіння:
Т пл = –205 °С, Т кип = –191 °C. Чистий газ не має запаху, але при добуванні його неповним окисненням вугілля відчувається характерний неприємний запах, який з’являється за рахунок неповного окиснення
деяких органічних сполук, наявних у кам’яному вугіллі. CO погано розчиняється у воді, тільки 25 мл газу в 1 л води. Карбон монооксид — надзвичайно отруйна сполука.
Добування карбон монооксиду
Невеликі кількості чадного газу в лабораторіях добувають шляхом розкладання мурашиної або щавлевої кислоти під дією гарячої концентрованої сульфатної кислоти:
Хімічні властивості карбон монооксиду
CO є гарним відновником. Величезні кількості чадного газу застосовують у металургійній промисловості для добування чистих металів:
Карбон монооксид є несолетворним оксидом, він не взаємодіє з водою, кислотами й лугами. При нагріванні суміші карбон (II) оксиду з киснем утворюється карбон діоксид:
Застосування карбон (II) оксиду
Карбон монооксид застосовують у металургії як відновник металічних руд. Перспективним є також застосування CO як гарного газуватого палива.
Вуглекислий газ зазвичай добувають спалюванням вуглецю або якого-небудь органічного палива (нафти, газу) в надлишку кисню:
Хімічні властивості карбон діоксиду
При розчиненні вуглекислого газу у воді утворюється нестійка карбонатна кислота.
Силіцій оксид
Силіцій оксид при нормальних умовах являє собою склоподібну тверду речовину з високими температурами фазових переходів.
Силіцій оксид, так само, як і карбон (IV) оксид, є кислотним оксидом, хоча сам він з водою не реагує (це знає кожен, тому що SiО2 — це не що інше, як пісок, а пісок з водою не взаємодіє). Силіцій оксиду відповідає силікатна кислота — H2SiО3. Ця кислота не розчиняється у воді.
При сплавлянні силіцій оксиду з лугами або основними оксидами утворюються силікати. Силікати — це солі силікатної кислоти:
Силікатна кислота являє собою тверду, не розчинну у воді речовину білого кольору, яка при добуванні з концентрованих розчинів утворює сирнистий осад, а з розведених розчинів виділяється у вигляді колоїдного розчину. Колоїдний розчин — це проміжний стан між справжнім розчином і суспензією, а розміри частинок у таких розчинах порядку 10 ¸ 100 молекул.
Силікатна кислота — це слабка двохосновна кислота. Її добувають дією на розчинні у воді силікати хлоридною або сульфатною кислотами:
Карбонати
Карбонатна кислота утворює два типи солей: середні солі і кислі.
Карбонати й гідрогенкарбонати зазвичай являють собою безбарвні або білі кристалічні сполуки (за винятком пофарбованого в зелений колір мінералу малахіту — основного купрум (II) карбонату.
Розчинні карбонати металів (Na2CO3, K2CO3 та NH4(CO2)3) при нагріванні не змінюються аж до температури плавлення, а нерозчинні карбонати при нагріванні розкладаються на оксид металу та вуглекислий газ:
На відміну від карбонатів, усі гідрогенкарбонати розчиняються у воді. Однак уже при несильному нагріванні (до +80 °С) гідрогенкарбонати розкладаються згідно з рівняннями:
Усі карбонати й гідрогенкарбонати взаємодіють із більш сильними кислотами, ніж карбонатна, наприклад з оцтовою (CH3COOH) або хлоридною (HCl) кислотами. При цьому виділяється вуглекислий газ і утворюються відповідні солі:
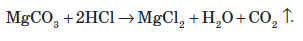
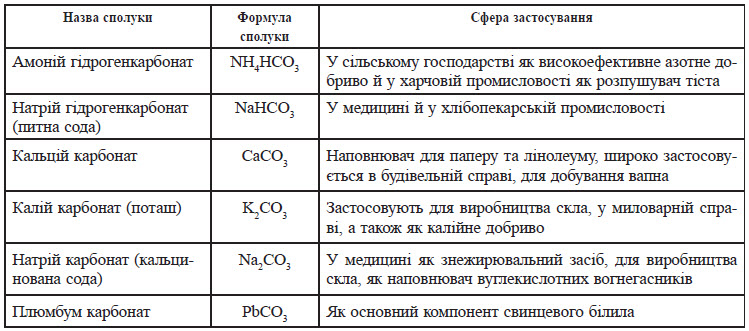
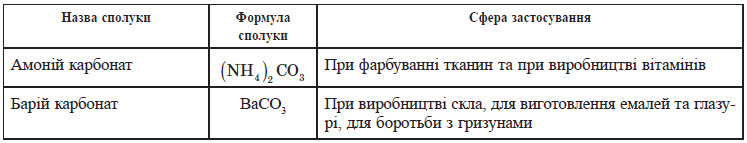
Застосування карбонатів і гідрокарбонатів
Якісна реакція на карбонат-іон
Для виявлення карбонат-іона використовують, в основному, дві реакції. Перша полягає в тому, що на досліджуваний розчин діють розведеними мінеральними кислотами, наприклад, сульфатною або хлоридною. При цьому, у разі присутності карбонатів, виділяються пухирці вуглекислого газу, що утворюється за такою реакцією:
У якісному аналізі також використовують той факт, що карбонати лужноземельних металів нерозчинні у воді. Тоді до досліджуваного розчину додають сіль Кальцію або Барію, унаслідок чого в розчині утворюється біла каламуть:
Силікати
З усіх силікатів у воді розчиняються тільки силікати лужних металів. Амоній силікат не отриманий. Зазвичай силікати добувають сплавлянням оксидів, гідроксидів або карбонатів металів із кремнеземом (силіцій(IV) оксидом):
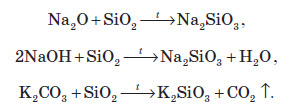
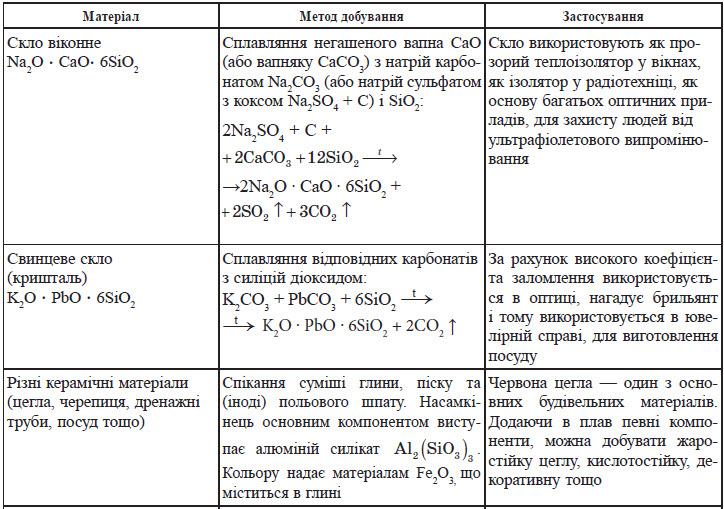
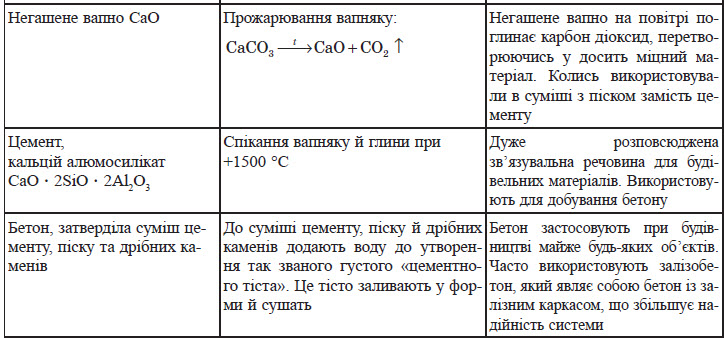
Силікати широко застосовують у виробництві будівельних матеріалів, що добре ілюструє таблиця:

Якісна реакція для виявлення силікат – іонів:
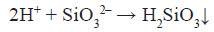
(драглистий осад)
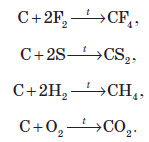
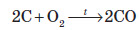
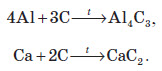
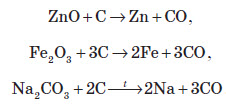
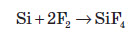
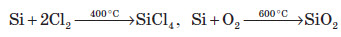
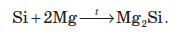
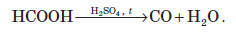
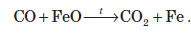
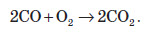
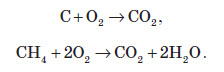
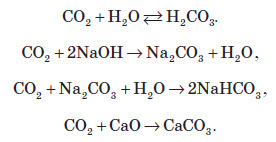
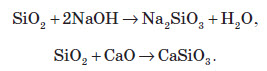
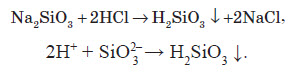
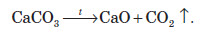
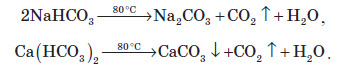
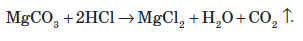
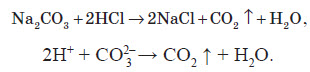
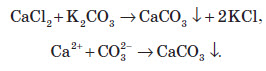
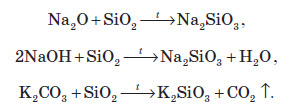



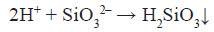 (драглистий осад)
(драглистий осад)

